Syndrome des ovaires polykystiques
WHEC Bulletin de pratique et de directives cliniques de gestion pour les fournisseurs de soins de santé. La concession éducative a fourni par Women's Health and Education Center (WHEC).Syndrome des ovaires polykystiques (SOPK) est une condition d'état inexpliquée anovulation chronique. En 1935, Stein et Leventhal le premier à décrire un ensemble de symptômes associés à l'anovulation. L'acceptation de ce syndrome comme une entité clinique singulière conduit à une approche assez rigide à ce problème pour de nombreuses années. Seules les femmes qualifiés qui avaient des antécédents de oligoménorrhée, l'hirsutisme et l'obésité avec une démonstration d'une hypertrophie des ovaires polykystiques. Il est beaucoup plus utile en clinique pour éviter l'utilisation de éponymes et même le terme de syndrome des ovaires polykystiques ou une maladie. Il est préférable de considérer cette question comme un problème d'anovulation persistante avec un spectre d'étiologies et les manifestations cliniques. Des résultats récents suggèrent un syndrome des ovaires polykystiques (SOPK) est séquelles métaboliques importantes, y compris le risque de diabète et, éventuellement, les maladies cardiovasculaires, et que le traitement primaire devrait se concentrer sur les séquelles métaboliques. Son étiologie demeure inconnue, et le traitement des symptômes est en grande partie fondée et empirique.
Le but de ce document est d'améliorer la compréhension des meilleures données disponibles sur le diagnostic et la gestion clinique du syndrome des ovaires polykystiques (SOPK). Une question qui a intrigué les gynécologues et les endocrinologues depuis de nombreuses années est ce qui cause des ovaires polykystiques. L'ovaire polykystique caractéristique se dégage lorsque l'état d'anovulation persiste pendant un certain temps. Que diagnostic par échographie ou par les critères cliniques traditionnels et biochimiques, une section des femmes anovulatoires en un point quelconque du temps sera révélé qu'environ 75% auront des ovaires polykystiques. Variété de traitements du SOPK sont également abordés dans ce chapitre et les prestataires de soins doivent apprécier l'impact clinique de l'anovulation et devrait entreprendre des directions appropriées.
Etiologie:
Aucun gène ou de la substance de l'environnement spécifique n'a été identifié comme causant SOPK. Résistance à l'insuline sélective mai être au centre de l'étiologie du syndrome: muscle squelettique est profondément résistants, et d'autres tissus (hypothalamus, surrénales, et de l'ovaire) restent sensibles aux effets de l'insuline. Des ovaires polykystiques est considéré comme un résultat d'un trouble fonctionnel, pas un défaut spécifique central ou local. Contrairement à l'image caractéristique de la fluctuation des taux d'hormones dans le cycle normal, un «état stable» de gonadotrophines et de stéroïdes sexuels peuvent être décrites en association avec anovulation persistante. Cet état stationnaire n'est que relative, et il est exagéré de présenter ici une notion de ce problème clinique. Compensatoire des niveaux accrus d'insuline mai entraîner une baisse des niveaux sex hormone binding globulin (SHBG) et servir comme un stimulus trophique pour la production d'androgènes dans la glande surrénale et de l'ovaire (1). Obésité mai être associés à trois modifications qui interfèrent avec l'ovulation normale, et la perte de poids améliore les trois: l'augmentation de l'aromatisation périphérique des androgènes en oestrogènes; des taux abaissés de sex hormone binding globulin (SHBG) résultant en des niveaux accrus d'estradiol libre et la testostérone, l'insuline a augmenté niveau qui peut stimuler la production de tissus ovariens stromales des androgènes.
Définition et critères diagnostiques:
Bien qu'il n'existe pas de définition universellement acceptée du SOPK, les critères diagnostiques établis par les Instituts nationaux de la Santé en 1990 à la définir comme une hyperandrogénie, et d'anovulation chronique dans les cas où des causes secondaires (comme les adultes d'apparition hyperplasie congénitale des surrénales, l'hyperprolactinémie et sécrétant des androgènes tumeurs) ont été exclus. Résistance à l'insuline a été noté de façon constante parmi de nombreuses femmes ayant une anovulation hyperandrogénie chronique inexpliquée, mais il n'est pas inclus dans les critères de diagnostic. Ultrasonograms des femmes ayant une anovulation hyperandrogénie chronique inexpliquée montrent souvent des ovaires polykystiques qui semblent, cependant, des ovaires polykystiques sont un non spécifique et sont également fréquemment observés chez les femmes sans anomalies endocriniennes ou métaboliques. Hyperandrogénie anovulation chronique survient dans environ 4-6% des femmes, sans différence significative dans la prévalence de l'hirsutisme ou élevé les taux d'androgènes circulant entre les femmes blanches et noires (2).
La prévalence du SOPK chez les femmes en âge de procréer est d'environ 5%, ce qui en fait l'un des troubles les plus courants en matière de reproduction. Chez les femmes présentant un dysfonctionnement ovulatoire, environ 70% souffrent du SOPK. Dans le plus grand essai clinique à ce jour des femmes du SOPK, 50-60% de la prospective 400 femmes identifiées comme ayant une anovulation chronique hyperandrogénie, avait aucune preuve de l'hirsutisme. Cependant, toutes les femmes atteintes d'hirsutisme aura excès d'androgène, et non pas toutes les femmes avec un excès d'androgènes aura hirsutisme. Hyperandrogénie peut être établie sur la base d'observations cliniques (par exemple, hirsutisme ou acné) ou de la mesure d'hormones ou les deux. L'ovaire polykystique est généralement élargie et se caractérise par une capsule nacrées blanches et lisses. Les caractéristiques de l'ovaire de tenir compte de ce dysfonctionnement est: la superficie est doublée, soit une augmentation moyenne du volume de 2,8 fois; le même nombre de follicules primordiaux est présent, mais le nombre de follicules en croissance et atrétique (jusqu'au stade de follicule secondaire) est doublé. Chaque ovaire mai contiennent 20-100 follicules kystiques. L'épaisseur de la tunique (couche la plus externe) est augmenté de 50%. Une augmentation d'un tiers de l'épaisseur du stroma cortical et un augmentation de 5 fois dans le stroma sous-corticales sont notées. Le stroma accrue est due à la fois une hyperplasie des cellules thécales et à une formation accrue à la suite de la maturation folliculaire et l'atrésie excessive. Il ya des nids de cellules 4 fois plus hile de l'ovaire (hyperplasie).
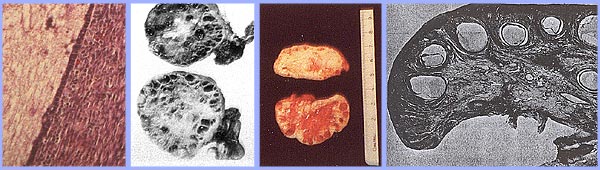
Ovaires polykystiques avec une capsule épaisse et visible, des kystes sous-capsulaire. Noter l'absence de corps jaunes ou albicantia corpus en raison d'anovulation.
Manifestations cliniques et de diagnostic:
Les femmes atteintes de SOPK généralement présents à l'infertilité ou troubles menstruels. En outre, les femmes atteintes de SOPK semblent être à risque accru de complications de la grossesse, y compris le diabète gestationnel et l'hypertension, le risque de ces complications est encore aggravée par des grossesses multiples (3). Niveaux anovulation chronique, l'obésité, l'hyperinsulinémie et une diminution de la SHBG sont tous associés au cancer de l'endomètre. Résistance à l'insuline et ses conditions associées, telles que l'acanthosis nigricans, la répartition des graisses centripète, l'obésité, l'obésité et les troubles liés au sommeil, sont autant de commun avec SOPK. À son tour, l'ensemble de ces facteurs de risque de séquelles à long terme du métabolisme comme le diabète de type II et les maladies cardio-vasculaires. L'examen physique devrait comprendre une évaluation de la calvitie, l'acné, hypertrophie clitoridienne, et la distribution poils du corps, ainsi qu'un examen pelvien à la recherche de l'élargissement de l'ovaire. Suggérés pour l'évaluation diagnostique du SOPK sont: Blood Pressure; indice de masse corporelle (IMC) (poids en kg divisé par la taille en m2) (kg / m 2), l'IMC de 25-30 = surpoids,> 30 = obésité; rapport taille-hanche déterminer la répartition des graisses corporelles, valeur> 0,72 = anormal, la présence de stigmates d'hyperandrogénie ou de résistance à l'insuline, tels que, l'acné, hirsutisme, alopécie androgénique, un acanthosis nigricans.
Les tests en laboratoire est de documenter l'hyperandrogénie (testostérone totale et / ou de la testostérone biodisponible ou libre) et l'exclusion des autres causes d'hyperandrogénie - les niveaux de l'hormone stimulant la thyroïde (fonction thyroïdienne); les taux de prolactine (hyperprolactinémie); 17-Hydroxyprogestrone (non classique hyperplasie congénitale des surrénales causée par déficit en 21-hydroxylase): niveau normal aléatoire <4 ng / ml ou le matin à jeun niveau <2 ng / ml. Parce que le syndrome de Cushing est extrêmement rare (1 sur 1,000,000) et les tests de dépistage ne sont pas 100% sensible ou spécifique, le dépistage systématique du syndrome de Cushing chez toutes les femmes présentant une anovulation hyperandrogénie chronique n'est pas indiqué. Ceux qui ont co-signe existantes du syndrome de Cushing, dont une face de lune, bosse de bison, des stries abdominales, la répartition des graisses centripète, ou l'hypertension, devraient être examinés (4). Évaluation des anomalies métaboliques: 2 heures test de tolérance au glucose par voie orale (glycémie à jeun <110 mg / dl = normal; 110-125 mg / dl = facultés affaiblies;> 126 mg / dl = diabète de type II), suivie par l'ingestion de 75 g de glucose par voie orale et puis 2 heures au niveau de glucose (<140 mg / dl = tolérance normale au glucose, 140-199 mg / dl = tolérance au glucose,> 200 mg / dl = diabète de type II). Lipides à jeun et le niveau de lipoprotéines (cholestérol total, de lipoprotéines de haute densité, triglycérides) devrait également être envisagée. Autres épreuves facultatives à considérer sont: La détermination de gonadotrophines pour déterminer la cause de l'aménorrhée, les taux d'insuline à jeun chez les femmes jeunes, les personnes ayant de graves stigmates de l'insulinorésistance et l'hyperandrogénie, ou ceux qui suivent une induction de l'ovulation. 24 heures de test d'urine pour le cortisol libre urinaire d'apparition tardive des symptômes du syndrome des ovaires polykystiques ou des stigmates du syndrome de Cushing sont utiles.
Androgènes tumeurs sécrétant de l'ovaire ou la glande surrénale sont toujours assorties de taux circulant élevé d'androgène. Cependant, il n'existe pas de niveau absolu qui est pathognomonique d'une tumeur, tout comme il n'existe pas de niveau minimum d'androgènes qui exclut une tumeur. L'évaluation du niveau DHEAS mai être utile en cas de virilisation rapide (comme un marqueur d'origine surrénalienne), mais son utilité dans l'évaluation de l'hirsutisme commun est discutable. Légère élévation du niveau de prolactine chez les femmes atteintes de SOPK est commun. Un prolactinomes qui sécrètent de grandes quantités de prolactine et que mai stimuler la production d'androgènes ovariens, mais ceci est une cause extrêmement rare d'anovulation hyperandrogénie chronique (5). Évaluer les niveaux sériques de l'hormone stimulant la thyroïde est aussi utile étant donné les manifestations protéiformes et la fréquence de la maladie de la thyroïde chez les femmes.
L'examen échographique des ovaires à l'évaluation de base et la morphologie avant l'induction de l'ovulation ou en cas de virilisation ou une conversion rapide à un état des androgènes en excès est très utile.
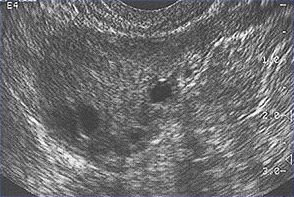
Cette image montre des follicules ovariens chez une femme ayant des cycles ovulatoires réguliers
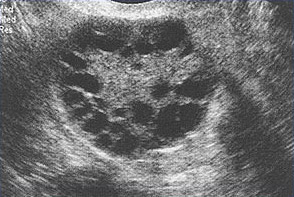
Multiples petits follicules sont présentés ici, chez une femme souffrant du SOPK.
Gestion:
Les conséquences cliniques de l'anovulation persistante sont: saignements utérins dysfonctionnels; aménorrhée, infertilité; hirsutisme, l'acné, le risque accru de cancer de l'endomètre et peut-être un cancer du sein, le risque accru de maladie cardio-vasculaire et un risque accru de diabète sucré.
Une maladie des ovaires polykystiques (SOPK) avec des saignements utérins dysfonctionnels ne cherche pas à concevoir:
- Les contraceptifs oraux combinés - il a été pilier à régulariser les cycles menstruels. Ils offrent des avantages au moyen de divers mécanismes, y compris la suppression de la sécrétion de l'hormone lutéinisante hypophysaire, la suppression de la sécrétion d'androgènes ovariens, et augmentation des taux circulants SHBG. Les «meilleurs» de la contraception orale pour les femmes atteintes de SOPK n'est pas connue. Les contraceptifs oraux sont aussi associés à une réduction significative du risque pour le cancer de l'endomètre, mais l'ampleur de l'effet chez les femmes atteintes de SOPK n'est pas connu (6).
- Progestatif - à la fois de dépôt et intermittentes d'acétate de médroxyprogestérone par voie orale (10 mg pendant 10 jours) n'a été démontré pour réprimer les gonadotrophines hypophysaires et androgènes circulants chez les femmes souffrant du SOPK. Utilisation de l'acétate de médroxyprogestérone a été associée avec une diminution de la SHBG chez les femmes souffrant du SOPK. Progestatifs contraceptifs oraux sont une alternative pour la protection de l'endomètre, mais ils sont associés à une incidence élevée des hémorragies utérines.
- Insulin-agents sensibilisants - Ces agents sont: les biguanides (metformine), les thiazolidinediones (troglitazone, la pioglitazone et la rosiglitazone), et un médicament expérimental d'insuline sensibilisant connu comme D-chiro-inositol. Ils n'augmentent pas la sécrétion d'insuline, comme les sulfonylurées, et sont donc rarement associés à l'hypoglycémie, un risque pour ceux qui sont normoglycémiques à jeun (comme le sont la plupart des femmes atteintes de SOPK). Il existe des différences de classe par exemple, les biguanides ont tendance à diminuer le poids et les thiazolidinediones d'augmenter le poids. Il est difficile de séparer les effets de l'amélioration de l'insulino-sensibilité de ceux d'abaisser sérique des androgènes, comme tout "pur" amélioration de la sensibilité à l'insuline peuvent augmenter la SHBG et donc de réduire les androgènes biodisponibles (7). Aucun des agents notés sont actuellement approuvés par la US Food and Drug Administration (FDA) pour le traitement du SOPK. Malgré des résultats préliminaires encourageants, la troglitazone a été retiré du marché mondial en raison d'une hépatotoxicité.
Syndrome des ovaires polykystiques (SOPK) à l'infertilité:
Il n'ya pas de preuves de schéma en fonction de guider les choix initiaux et ultérieurs des méthodes d'induction de l'ovulation chez les femmes souffrant du SOPK. Le traitement doit débuter avec un traitement par l'exercice régulier et le contrôle du poids et passer ensuite à d'autres méthodes si nécessaire. La plupart utilisent couramment des agents pour induire l'ovulation sont les suivants:
- Le citrate de clomiphène - cela a toujours été l'agent de traitement de première ligne pour anovulation. Jusqu'à 80% ou des femmes atteintes de SOPK ovuleront en réponse à un traitement de clomifène et 50% de ces femmes peuvent concevoir. La moitié de toutes les femmes qui vont se concevoir à l'aide de clomifène le fera avec les 50 mg en dose de départ, et 20% le feront avec le 100 mg par jour posologie. La plupart des grossesses se produisent au cours des six premiers cycles ovulatoires. L'augmentation de la durée du traitement augmente peu le taux de grossesse. Schémas thérapeutiques de clomifène alternatives ont été développées, par exemple en prolongeant la période d'administration et l'ajout de la dexaméthasone. Dexaméthasone comme traitement adjuvant par le citrate de clomifène a été montré pour augmenter les taux d'ovulation chez les femmes atteintes de SOPK DHEAS avec des niveaux plus élevés (> 2.000 ng / mL) (8).
- Gonadotropins - ils sont fréquemment utilisés pour induire l'ovulation chez les femmes atteintes de SOPK chez lesquels le traitement de clomifène a échoué. Low-dose de traitement par les gonadotrophines offre un taux plus élevé de développement monofollicular (environ 50% ou plus) avec une réduction significative du risque de syndrome d'hyperstimulation ovarienne (20-25%) qui entraîne l'annulation du cycle ou plusieurs séquelles graves (9).
- Metformin - agent sensibilisateur à l'insuline a montré qu'il améliore la fréquence ovulatoire chez les femmes souffrant du SOPK. La posologie la plus fréquemment utilisée a été 1500 mg par jour, et des études plus récentes ont utilisé de 2.000 mg par jour en doses fractionnées. Metformine a également été utilisé avec succès comme agent d'appoint à la fois avec le citrate de clomiphène et les gonadotrophines. La metformine entraîne un faible risque d'acidose lactique, le plus souvent chez les femmes atteintes de diabète mal contrôlé et de la fonction rénale est altérée. Symptômes gastro-intestinaux (diarrhée, nausées, vomissements, ballonnements abdominaux, la flatulence et anorexie) sont les réactions indésirables les plus fréquents et mai être atténués en commençant par une petite dose et en augmentant progressivement la dose ou en utilisant la version à libération soutenue maintenant disponible dans la États-Unis. La metformine n'a pas connu de risque tératogène chez l'homme ou la létalité embryonnaire chez l'homme et semble sécuritaire pendant la grossesse. Some clinicians advocate its use during early pregnancy to reduce the miscarriage rate, but the documentation for this claim is poor (10) .
- Les thiazolidinediones - ils sont l'activation des récepteurs des proliférateurs des peroxysomes (PPAR-y) agonistes et sont pensées pour améliorer la sensibilité à l'insuline au moyen d'un mécanisme récepteur poste. Il est efficace dans l'amélioration de l'ovulation et l'hirsutisme. Ces avantages semblent être induits par diminution de l'hyperinsulinémie et une diminution des niveaux de testostérone libre (avec un accroissement correspondant SHGB).
Drilling ovarien: la valeur de forage de l'ovaire laparoscopique avec laser ou par diathermie comme traitement primaire pour des sous-femmes fertiles avec anovulation et SOPK est indéterminée. Ni perçage par laser et n'a aucune diathermie avantages évidents, et il n'y a pas suffisamment de preuves pour suggérer une différence dans l'ovulation ou les taux de grossesse lorsque le forage est comparé avec les gonadotrophines thérapie comme un traitement secondaire pour les femmes qui ne répondent pas au clomifène. Taux de grossesses multiples sont réduits chez les femmes qui conçoivent après le forage laparoscopique. Dans certains cas, les avantages de fécondité de forage de l'ovaire mai être temporaire, et le forage ne semble pas améliorer les anomalies métaboliques chez les femmes atteintes de SOPK (11).
Step-by-Step Approach to induction de l'ovulation chez les femmes atteintes de SOPK:
Les moins de ressources des interventions intensives sont recommandées dans les premières étapes dans le protocole, tandis que la plupart des ressources des interventions intensives sont de réserve pour un traitement ultérieur (12);
Étape 1: Si l'IMC est supérieur à 30, recommander la perte de poids d'au moins 10% du poids corporel.
Étape 2: Prescrire clomifène à induire l'ovulation.
Étape 3: Si DHEAS est supérieur à 2 micro g / ml, envisager la combinaison de clomifène avec un glucocorticoïde pour induire l'ovulation.
Étape 4: Si clomifène ne se traduit pas dans l'ovulation, envisager une combinaison de metformine plus clomifène.
Étape 5: Mise à faible dose des injections de FSH.
Étape 6: Entreprendre une faible dose des injections de FSH et metformine.
Étape 7: Tenir compte de la chirurgie laparoscopique de l'ovaire (forage) ou la fécondation in vitro (FIV).
Ovaires polykystiques et des fibromes utérins:
L'absence d'un effet préjudiciable du SOPK sur le flux de sang artère utérine chez les femmes de 35 ans correspond à la hyperandrogenization diminué et la tendance vers plus de cycles réguliers signalés chez les femmes âgées atteintes de SOPK. Elle pourrait être la réflexion hémodynamiques de la biochimie améliorés, tels l'ovaire et de la fonction de ce groupe d'âge. En outre, le fait que moins de patients souffrant du SOPK ont des fibromes utérins dans de nombreuses études que celles dont les ovaires sont normales n'a pas été précédemment rapporté. Ce résultat contredit une étude qui a impliqué 21-69 ans, femmes afro-américaines utilisant des questionnaires de poste pour le recrutement des patients (13). La différence pourrait tenir compte des deux différentes tranches d'âge du groupe et les méthodologies utilisées dans les deux études. La corrélation négative entre la présence du SOPK et les fibromes et l'absence de corrélation significative entre l'âge et des fibromes chez les femmes atteintes de SOPK dans cette étude suggèrent un rôle protecteur pour les PCOS à cet égard. Il est probable que la baisse perfusion sanguine myomètre chez les femmes atteintes de SOPK, comme montré dans cette étude et d'autres, a été un facteur contribuant à réduire leur risque de développer des fibromes. En outre, la tendance hyperadrogenic atteintes de SOPK même chez les femmes ayant des cycles menstruels réguliers auraient pu avoir un effet protecteur sur les muscles que les fibromes utérins en général se développer plus facilement dans un environnement oestrogénique. Cette étude (14) a montré que les patients souffrant du SOPK sont moins susceptibles d'avoir des fibromes utérins. L'effet nuisible du SOPK sur le flux sanguin utérin chez les femmes ayant des cycles menstruels réguliers ont ajouté un aspect hémodynamique à des anomalies endocriniennes précédemment rapportés dans des groupes semblables de patients. L'âge du patient et de la parité a modulé les effets du SOPK et des fibromes utérins sur les flux de l'artère sanguine. En conséquence, tout énoncé portant sur le débit sanguin utérin à la présence ou l'absence du SOPK ou les fibromes devraient prendre ces deux facteurs en considération.
Chez les femmes obèses atteintes de SOPK, ne la perte de poids améliore la fonction des ovaires?
L'obésité contribue de manière substantielle à la reproduction et des anomalies métaboliques chez les femmes souffrant du SOPK. De multiples études ont montré qu'une perte de poids peut améliorer les aspects fondamentaux du syndrome endocrinien du SOPK en abaissant les taux circulants d'androgènes et provoquant une reprise spontanée des règles. Réduction du poids corporel a été associée à l'amélioration des taux de grossesse et une diminution de l'hirsutisme, ainsi que l'amélioration des niveaux de glucose et des lipides. Les études utilisant des agents pharmacologiques perte de poids, tels que l'orlistat et de l'inhibiteur de l'absorption intestinale des lipides, et la sibutramine et l'agent anorexiques, chez les femmes atteintes de SOPK ont démontré une amélioration similaire dans la fonction ovarienne (15). Maladivement les femmes obèses atteintes de SOPK qui subissent une expérience de la chirurgie de pontage près normalisation de leurs anomalies de la reproduction et métaboliques. Ces changements ont été rapportés avec une perte de poids aussi peu que 5% du poids initial. La diminution des niveaux non consolidé testostérone après la perte de poids mai être largement médiatisé par des augmentations de la SHBG (16). Les effets de la perte de poids chez les femmes de poids normal avec SOPK sont inconnus.
Résumé:
Syndrome des ovaires polykystiques est définie comme la présence de oligoménorrhée ou aménorrhée et hyperandrogénie en l'absence d'autres troubles hyperandrogénie, tels que les androgènes tumeurs sécrétant ou une hyperplasie surrénale non classiques. Preuves cliniques de l'hyperandrogénie comprend l'hirsutisme et l'acné. Preuve en laboratoire d'hyperandrogénie comprend un total élevé, biodisponible, ou la concentration de testostérone libre. Sérique de sulfate de déhydroépiandrostérone (DHEAS) ou les niveaux de l'androstènedione sont également la preuve d'hyperandrogénie. Les caractéristiques morphologiques de «ovaires polykystiques" comme l'a montré à l'échographie pelvienne ne sont pas essentielles pour le diagnostic du SOPK, mais l'appui du diagnostic. Chez les femmes atteintes de SOPK, de nombreux traitements sont disponibles pour traiter l'infertilité anovulatoire, y compris la perte de poids, le clomifène, le clomiphène et metformine, le clomiphène, plus de glucocorticoïdes, les injections de gonadotrophines, la chirurgie ovarienne, fécondation in vitro et transfert d'embryon (FIVETE).
Toutes les femmes atteintes de SOPK doit être examiné pour une intolérance au glucose avec une glycémie à 2 heures après un défi 75 glycémie à jeun. Interventions qui améliorent la sensibilité à l'insuline, y compris la perte de poids, l'utilisation de la metformine, et l'utilisation des thiazolidinediones, sont utiles pour améliorer la fréquence de l'ovulation chez les femmes souffrant du SOPK. L'utilisation de citrate de clomifène est appropriée parce qu'elle efficace des résultats de la grossesse chez les femmes souffrant du SOPK. L'amélioration de la sensibilité à l'insuline, par la perte de poids ou par l'utilisation de l'insuline-agents sensibilisants, mai favorablement améliorer nombreux facteurs de risque pour le diabète et les maladies cardiovasculaires chez les femmes avec POCS. Lors de l'utilisation d'inciter les gonadotrophines, la thérapie à faible dose est recommandée parce qu'elle offre un taux élevé de développement monofollicular et un risque significativement plus faible de l'hyperstimulation ovarienne chez les femmes souffrant du SOPK. Le bénéfice et le rôle du traitement chirurgical dans l'induction de l'ovulation chez les femmes atteintes de SOPK est incertaine. Le meilleur ou le traitement initial de l'hirsutisme, l'induction de l'ovulation ou la prévention des séquelles à long terme du métabolisme pour les femmes atteintes de SOPK est inconnue. Toutes ces conditions mai bénéficier d'une modification de style de vie.
Références:
- Azziz R, Ehrmann D, Legro RS et al. Troglitazone improves ovulation and hirsutism in the polycystic ovary syndrome: a multicenter, double blind, placebo-controlled trial. J Clin Endocrinol Metab 2001;86:1626-1632. (Level I)
- ACOG Practice Bulletin. Polycystic ovary syndrome. Number 108, October 2009
- Chang RJ. A practical approach to the diagnosis of polycystic ovary syndrome. Am J Obstet Gynecol 2004;191:713-717
- Park JK, Loucks TL, Berga SL. Polycystic ovary syndrome. In: Falcone T, Hurd WW eds. Clinical reproductive medicine and surgery. New York: Elsevier; 2007. p. 217-232
- Kolodziejczyk B, Duleba AJ, Spaczynski RZ et al. Metformin therapy decreases hyperandrogenism and hyperinsulinemia in women with polycystic ovary syndrome. Fertil Steril 2000;73:1149-1154
- Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome. Fertil Steril 2008;89:505-522
- Chang PL, Lindheim SR, Lowre C et al. Normal ovulatory women with polycystic ovaries have hyperadrogenic pituitary-ovarian responses to gonadotropin-releasing hormone agonist testing. J Clin Endocrinol Metab 2000;85:995-1000
- Glueck CJ, Philips H, Cameron D et al. Continuing metformin throughout pregnancy in women with polycystic ovary syndrome appears to safely reduce first-trimester spontaneous abortion: a pilot study. Fertil Steril 2001;75:46-52 (Level III)
- Farquhar CM, Willamson K, Gudex G et al. A randomized controlled trial of laparoscopic ovarian diathermy versus gonadotropins therapy for women with clomiphene citrate-resistant polycystic ovary syndrome. Fertil Steril 2002;78:404-411. (Level I)
- La Marca A, Artensio AC, Stabile G et al. Metformin treatment of PCOS during adolescence and the reproductive period. Eur J Obstet Gynecol Reprod Biol 2005;121:3-7
- Zain MM, Jamaluddin R, Ibrahim A et al. Comparison of clomiphene citrate, metformin, or the combination of both for first-line ovulation induction, achievement of pregnancy, and live birth in Asian women with polycystic ovary syndrome: a randomized controlled trial. Fertil Steril 2009;91:514-521. (Level I)
- Nestler JE. Metformin for the treatment of the polycystic ovary syndrome. N Engl J Med 2008;358:47-54
- Wise L, Palmer J, Stewart E et al. Polycystic ovary syndrome and risk of uterine leiomyomata. Fertil Steril 2007;87:1108-1118
- Abdel-Gadir A, Oyawoye OO, Chander BP. Coexistence of polycystic ovaries and fibroids and their combined effect on the uterine artery blood flow in relation to age and parity. J Reprod Med 2009;54:347-352
- Lindholm A, Bixo M, Bjorn I et al. Effect of sibutramine on weight reduction in women with polycystic ovary syndrome: a randomized, double-blind, placebo-controlled trial. Fertil Steril 2008;89:1221-1228. (Level I)
- ACOG Practice Bulletin. Polycystic ovary syndrome. Number 108, October 2009. Obstet Gynecol 2009;114:936-949
Publié: 19 November 2009
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


