Cáncer de mama: detección temprana
WHEC Boletín de la práctica clínica y directrices de gestión de los proveedores de atención médica. Educación subvención concedida por el Women's Health and Education Center (WHEC).Se calcula que 217,640 casos nuevos de cáncer de seno serán diagnosticados en Estados Unidos este año, más del 99% de estos cánceres de seno ocurren en mujeres. El cáncer de mama es la neoplasia maligna más frecuente entre las mujeres de EE.UU. y es la segunda causa de muerte por cáncer entre las mujeres estadounidenses (el cáncer de pulmón es la primera). Riesgo de por vida de una mujer (80 años de vida-la vida) de desarrollar cáncer de mama es del 12,5%, o 1 de cada 8. La detección temprana del cáncer de mama ha demostrado que disminuye la tasa de mortalidad. La tecnología continúa evolucionando para mejorar la exactitud de la detección.
El propósito de este documento es discutir las razones para las actuales pautas de detección del cáncer de mama y evaluar las pruebas relativas a las técnicas de detección. También se centra en la mamografía y otras técnicas de detección como herramientas para identificar lesiones no palpables. Esta información está diseñada para ayudar a los profesionales en la toma de decisiones sobre el cuidado apropiado. Variaciones en la práctica puede ser justificada sobre la base de las necesidades de cada paciente, los recursos y las limitaciones único de las instituciones o el tipo de prácticas.
Factores de riesgo:
La epidemiología analítica - ¿Por qué las mujeres adquieren el cáncer de mama es menos conocida. Varios factores han sido identificados con mayor riesgo, tales como: enfermedad benigna de mama, factores genéticos, la dieta, las hormonas exógenas, el alcohol y el consumo de tabaco, el trauma de mama y virus. Aumenta el riesgo de cáncer de mama por ser mujer y envejecer, el 70% de los cánceres se producen más de 50 años de edad. Antecedentes familiares de cáncer de mama en una primaria madre relativa (, hermana o hija) aumenta el riesgo. Otros factores son: inicio temprano de la menstruación (período de conseguir antes de los 12 años), nunca de dar a luz o el primer embarazo de más de 30 años de edad, que pesen más de 40% por encima del peso corporal ideal y la exposición al DDT (plaguicida), PCB, o excesivo la radiación a la pared torácica.
Varios estudios han demostrado que los más importantes factores de riesgo patológico para el posterior desarrollo de carcinoma son el grado y la naturaleza (típicos o atípicos) de la proliferación epitelial.
Diagnóstico de la patología de mama agrupados por el riesgo de cáncer (1):
- Ningún aumento de riesgo
- Adenosis esclerosante o florida metaplasia apocrina
- Quistes, macro o micro
- Ectasia ductal
- Fibroadenoma
- O la fibrosis (leve), hiperplasia
- Mastitis
- Periductal la mastitis
- Metaplasia escamosa
- Ligero aumento del riesgo
- Hiperplasia moderada o florida
- Papiloma, sólido o papilar, con fibro-vascular central
- Moderado aumento de riesgo
- Hiperplasia atípica; ductos / lobular
Detección del cáncer de mama
Las herramientas de detección son sólo tan eficaz como su capacidad para ayudar en la prevención de enfermedades. El método de cribado ideal debe identificar biológica y cambios estadísticamente significativos asociados con el desarrollo del cáncer. También debería ser aplicable a una proporción razonable de los individuos en riesgo, y debe ser mínimamente invasiva. Además, la intervención y medidas efectivas de prevención deben estar disponibles. La búsqueda de mejores métodos de prevención y detección del cáncer de mama continúa con el objetivo de reducir la mortalidad de manera significativa, como ha ocurrido con el cáncer cervical.
Obstetras y ginecólogos se encuentran en una posición favorable para diagnosticar enfermedades del seno en sus pacientes. Paso inicial hacia el este es el examen de mama por inspección visual y palpación y debe ser parte integrante de la formación inicial de obstetricia y todos los exámenes ginecológicos completos. Los pacientes deben ser instruidos en la técnica de la vida, la autoevaluación periódica largo examen de la mama y con conocimiento de la importancia de la auto-examen.
Auto-Examen del Seno (EEB):
A pesar de la falta de datos definitivos a favor o en contra de autoexamen de mamas (EEB), el autoexamen de mamas tiene el potencial para detectar el cáncer de mama palpable y debe ser recomendada. El cáncer de mama es el más auto-descubierto de todos los cánceres. De hecho, la mayoría de los cánceres de mama en los Estados Unidos se detectan por palpación. Auto examen de senos (BSE) debe hacerse de una cómoda habitación que contiene una cama (incluida una almohada), un espejo y buena iluminación. Puede realizar la EEB cuando estás en la ducha, algunas mujeres encuentran que una mano húmeda es útil para detectar cambios en sus senos. Recuerde que para llevar a cabo la EEB mientras se está acostado, además de ponerse de pie. Los senos son órganos dinámica y los cambios pueden ocurrir etapas de la vida mensual y todo (la adolescencia, maternidad, menopausia). EE.UU. Food and Drug Administration ha aprobado ayudas para la EEB, que están diseñados para mejorar la sensación táctil. Es una buena idea para dibujar un boceto de lo que siente en su EEB y de marcar su calendario.
Tenga en cuenta que la mayoría de los tumores de seno no son cancerosos. De hecho, se ha estimado que sólo uno de cada 11 bultos es un tumor. La EEB es libre y no-tóxicos y algunos médicos creen que la EEB ayuda a empoderar a las mujeres a tomar el control de su propia salud. Adecuado auto-examen de mama mensual, varios días después del final del ciclo menstrual y un examen clínico por un profesional de la salud capacitados una vez al año, se sugiere.
Pasos para Auto-Examen del Seno
Mamografía:
La mayoría de las mujeres diagnosticadas con cáncer de mama no tienen factores de riesgo evidentes. En 1966, Macdonald estima cáncer invasivo duplicando el tiempo de la gama 23 a 209 días, con un promedio de 128 días para el cáncer localizado y 85 días para el cáncer metastásico. Un gráfico sobre la base de cálculo matemático de 100-días el tiempo de duplicación que existían 8 años de duración y una fase clínica de 4 años de fase clínica de crecimiento del cáncer de mama, que se produce antes de que el tamaño normal cuando se diagnostica cáncer de mama. Mamografía podría identificar a una masa no palpable de aproximadamente 1 mm a 1 cm en su fase pre-clínica 3 años antes de que se hace palpable (2). La mayoría de los estudios de la mortalidad de mamografía utiliza como punto final, por lo que el valor de la evaluación a menudo se basa únicamente en las tasas de mortalidad. Pocos estudios se tengan en cuenta los efectos de la detección temprana de la calidad de vida o el hecho de que el tratamiento en las fases anteriores lleva a una menor morbilidad. En 1982, la detección del cáncer de mama Proyecto de Demostración de establecer la aplicabilidad de la detección del cáncer de mama con mamografía para identificar lesiones no palpables. 5-El resultado del año demostró que el 8,7% de los cánceres de mama se detecta mediante un examen físico solamente, el 41,6% fueron detectadas por mamografía solamente, y el 47,3% fueron detectados por tanto en la mamografía y un examen físico. De cáncer infiltrante de mama menores de 1 cm, el 52,6% sólo se han detectado por mamografía. Entre las 4.240 mujeres en las que el cáncer de mama se detecta y se trata, el 10-tasa de supervivencia fue del 79% (3).
Sobre la base de Health Insurance Plan of Greater New York y Detección de Cáncer de Mama de datos de proyectos de demostración, el plomo estimaciones del tiempo (el tiempo entre la detección por mamografía y cuando la lesión es clínicamente detectable) para el cáncer de mama invasivo es de 1,7 años (rango: 0,4 -3 años), lo que sugiere que el intervalo de detección óptimo sería no más de 1,7 años. La mayoría de la mamografía de cribado ensayos clínicos había un criterio de límite superior de edad que van 64-74 años. Medical co-morbilidad y la esperanza de vida debe ser considerada en un cáncer de mama, programa de detección para las mujeres mayores de 75 años o más, porque el beneficio a razón de riesgo de la mamografía de cribado continúa cambiando negativamente con la edad. Una de las recomendaciones de consenso no existe. Sin embargo, meta-análisis concluyó que la mamografía de cribado en mujeres de 70-79 años es moderadamente rentable y produce un pequeño aumento en la esperanza de vida (3).
Recomendaciones para el cribado del cáncer de mama:
- El Colegio Americano de Obstetras y Ginecólogos (ACOG)
- Debe realizar una mamografía cada 1-2 años para las mujeres 40-49 años de edad y luego anualmente.
- Todas las mujeres deben tener un profundo examen de mamas anual y se realicen un autoexamen de mamas mensualmente, el mejor realizado durante la fase folicular (después del ciclo menstrual es mayor) del ciclo.
- La American Cancer Society (ACS)
- Las mujeres de 40 años y mayores deben tener una mamografía anual, tienen un examen clínico de mama anual realizado por un profesional de la salud, y realizar el autoexamen mensual de examen. El examen clínico de los senos debe llevarse a cabo cerca de la mamografía regular.
- Las mujeres de 20-39 años deben tener un examen clínico de los senos realizado por un profesional de la salud cada 3 años y se practiquen el autoexamen de mamas mensualmente.
Consecuencias negativas de la mamografía de cribado:
Las primeras preocupaciones sobre el riesgo de la radiación (por ejemplo, la inducción de cáncer de mama por la radiación) han sido reducidas en gran medida por las mejoras en la técnica de la mamografía, la tecnología y la experiencia clínica. Mamografías de falsos positivos (es decir, aquellos con alteraciones percibe que requieren más evaluación para comprobar que la lesión no es cáncer) son una preocupación continua. Falso: las mamografías de cribado de mamografía de diagnóstico positivo requiere con vistas complementarias, ecografía, e incluso una biopsia en el 20-30% de los casos, en un intento de llegar a un diagnóstico preciso. Las consecuencias psicológicas de la mamografía se han identificado y revisado y los psicológicos, conductuales y de calidad de temas de la vida parece ser intrínseca al temor de cáncer de mama.
Otras técnicas de detección:
La ecografía es un complemento de la mamografía establecido en la evaluación de imágenes. Es útil en la evaluación de los resultados concluyentes de mamografía, en la evaluación de pacientes jóvenes y de otras mujeres con tejido mamario denso, en el núcleo del tejido rectores biopsia con aguja y otras técnicas de biopsia, y en la diferenciación de un quiste de una masa sólida. Fine-punción aspiración con aguja, en particular en Europa, ha reemplazado a la biopsia por escisión para la evaluación de las anormalidades mamográficas. Muchas veces el diagnóstico definitivo no es posible, principalmente a causa de su incapacidad para diferenciar invasoras de carcinoma in situ. Estereotáctica guiada biopsia con aguja gruesa (CNB), que utiliza una aguja de calibre grande, parece tener varias ventajas sobre multa citología por aspiración con aguja. CNB es menos costoso que la biopsia por escisión, se traduce en una menor morbilidad, y no deja cicatrices visibles. Algunas lesiones benignas tienen una incidencia relativamente alta de carcinoma de la coexistencia, y el CNB, con su pequeño volumen de tejido puede no ser suficiente para descartar el cáncer.
La resonancia magnética puede ser un complemento útil a la mamografía de diagnóstico, pero el costo, la duración del examen, y la inyección de material de contraste se prohibe su uso como técnica de cribado de rutina, basada en la población. Ecografía Doppler color, detección asistida por ordenador, tomografía por emisión de positrones, gammagrafía de mamografía, paso a la mamografía oblicua, y la termografía han demostrado ser prometedores en determinadas situaciones la selección, pero siguen bajo investigación clínica y no han propuesto como las técnicas de detección eficaz.
-El lavado ductal en el cáncer de mama de detección:
Aunque los estudios de imagen actuales han demostrado ser eficaces en la identificación de tumores malignos, que tienen una capacidad limitada para detectar en las lesiones in situ. Ductoscopy es invasiva, y requiere sedación y la anestesia. Existen varios procedimientos para obtener células ductales de la evaluación, tales como la acumulación de líquido aspirado del pezón (NAF), al azar periareolar aspiración con aguja fina, y el lavado ductal. El pezón contiene en promedio ocho y cincuenta y cinco minutos de la leche poros. Cada uno de los poros se extiende en un conducto central, que ha lateral unidad lobular, donde la leche se produce durante la lactancia. Los lobulillos terminan en la unidad de la terminal ductal lobulillar, donde la leche se produce durante la lactancia. La investigación ha sugerido que la atipia celular es biomarcador importante que precede a la mayoría de las lesiones malignas, y es altamente predictiva de desarrollar cáncer del seno. Teniendo en cuenta la teoría de que los conductos de activos son más propensos a producir las células, los pacientes deben también ser seleccionados en base a su capacidad de rendimiento de aspiración de líquido del pezón (NAF), con la aspiración de succión suave. Este proceso también identifica el orificio de la obtención de los conductos de líquido para el lavado.
Para llevar a cabo el lavado ductal, se aplica anestesia tópica, y el orificio del conducto cánula con un catéter flexible microempresas. Anestésico es entonces a menudo inyectados a través del catéter para adormecer el conducto. Se introduce solución salina para lavar a través de la unidad lobular ductal, y luego el líquido se recoge. La muestra se prepara con la tinción de Papanicolau estándar, y evaluó citológico. El lavado ductal se debe utilizar en conjunto con, y no en lugar de, examen clínico de mama y la mamografía. La American Cancer Society (ACS) estima que el lavado ductal puede ser útil para ayudar al pequeño grupo de pacientes de alto riesgo para evaluar mejor sus riesgos y tomar decisiones sobre el tamoxifeno, la terapia hormonal, y la profilaxis quirúrgica. La Sociedad Americana de Cirujanos de mama también ha emitido una declaración oficial de apoyo lavado ductal.
Cáncer de mama cribado genético:
Las células tienen dos copias - BRCA1 y BRCA2, y son los genes supresores de tumores. Los productos proteicos de estos genes interactúan unos con otros en una vía que repara el ADN dañado. BRCA1 - 2 mutaciones aumentan el riesgo de cáncer de más de otros factores y que estas mutaciones aumentan el riesgo de aparición de cáncer de mama. A pesar de un estimado de 50-80% de riesgo de por vida de cáncer de mama para los que llevan la mutación BRCA1 o BRCA2, pocos han advertido ningún cambio en la población basado en las directrices para el cribado mamográfico en este grupo de alto riesgo. Nivel Reconociendo que no hay datos de vigilancia o relacionadas con los ensayos clínicos están disponibles para las portadoras de BRCA1 o BRCA2, el cáncer de Estudios Genéticos Consorcio ha ofrecido-III recomendaciones provisionales de 1) la educación sobre el autoexamen de mamas mensual de examen, 2) anuales o semestrales de auto-examen clínico de mama comenzando a la edad de 25-35 años, y 3) una mamografía anual a partir de las edades 25-35 años (4).
Lecciones aprendidas de la prueba de BRCA:
- Myriad, 2002 (10.000 pacientes examinados) - los portadores del gen muchos tenían poco o ningún historial familiar de cáncer de mama / ovario.
- MC King, 2003 (104 Ashkenazi BRCA Carriers) - la mitad no tenía historia de cáncer de mama / ovario en la primera mujer-o parientes de segundo grado.
La incidencia de las mutaciones BRCA1 y 2 en la población Ashkenazi es 1 / 40 y en la población no Ashkenazi es 1 / 400 a 1 / 800. En caso de todas las mujeres Ashkenazi se proyectará fundador de mutaciones BRCA? Los argumentos a favor son: identifica primeros portadores de la mutación, dando lugar a la prevención o el diagnóstico precoz. La discriminación genética es probable que sea una preocupación. Los argumentos en contra son: falso negativo si las mutaciones fundador sólo son examinadas y falso sentido de seguridad para aquellos que negativo en la prueba y llevar a riesgo inicial de cáncer.
La cobertura del seguro está ampliamente disponible para las pruebas genéticas. 97% de las reclamaciones de seguro cumplidos 2000-2001 fueron reembolsados en un promedio de 94% de reembolso. Muchas compañías de seguros han establecido directrices para determinar la elegibilidad para el asesoramiento y las pruebas. Medicare ahora paga para las pruebas. Los beneficios son: proporciona información sobre los riesgos para los individuos y las familias, proporciona información útil en la asistencia sanitaria y los resultados pueden aliviar la incertidumbre y la ansiedad. Las limitaciones son: un resultado negativo es más definitiva si hay una mutación conocida en la familia. Algunas variantes genéticas son de significado clínico desconocido.
La quimioprevención:
La búsqueda de medios para prevenir el cáncer de mama ha sido constante durante muchos años. El tamoxifeno (un trifeniletileno), que es un anti-estrógeno a pesar de que está químicamente relacionada con un estrógeno, fue realmente el primer modulador selectivo del receptor de estrógeno. Ha habido más de un cuarto de siglo de experiencia con el tamoxifeno como adyuvante en pacientes con cáncer de mama. Debido a que los datos sugieren una protección considerable en el desarrollo de cáncer de mama contralateral en las mujeres que recibieron tamoxifeno versus los que no recibieron el tamoxifeno, un gran prevención del cáncer de mama (P-1) se inició en 1992 (National Surgical Adjuvant Breast Project [NSABP] / NCL) . El modelo de Gail, un algoritmo para calcular el riesgo de cáncer de mama, determina un alto riesgo. El modelo de Gail está pensado para las mujeres en un programa de cribado con mamografía anual.
Modelo de Gail para determinar el riesgo de cáncer de mama (5):
- Edad
- Número de afectados familiares de primer grado
- La edad de la menarquia
- Edad al primer parto
- Número de biopsias de mama anteriores
- La presencia de hiperplasia atípica en la muestra de biopsia
Este modelo predice el riesgo de cáncer de mama en 5 años o la esperanza de vida. Más recientemente, los estrógenos moduladores selectivos del receptor de otros se han convertido en disponibles para la evaluación, el raloxifeno es el más ampliamente estudiado. Esta droga se utiliza principalmente para determinar la prevención de la osteoporosis postmenopáusica en los participantes de los resultados de varios de Evaluación de Raloxifeno (MORE) que fueron tratados durante 3 años. El riesgo de cáncer de mama invasivo fue del 76% menor en el grupo de raloxifeno que en el grupo placebo. Esto se atribuyó a un descenso del 90% en el desarrollo de receptores de estrógeno tumores positivos. Estos resultados han llevado al estudio de Tamoxifeno y Raloxifeno (STAR) de prueba para la evaluación de estos fármacos en la prevención del cáncer de mama invasivo en mujeres posmenopáusicas que corren un alto riesgo para esta enfermedad.
Otros estimadores de riesgo posible y herramientas de diagnóstico:
Hiperplasia atípica: se presenta temprano en el proceso continuo de cambios histológicos que constituyen el proceso de transformación hacia el fenotipo maligno. Un hallazgo histológico o citológico de atipia es un factor de riesgo para desarrollar cáncer de mama. El riesgo es más del doble para las mujeres con historia familiar de cáncer de mama (riesgo relativo: atipia solo, ~ 5; atipia + historia familiar, 11-18), y aproximadamente el 40% de estas mujeres desarrollará cáncer de mama durante su vida. Hiperplasia atípica puede ser utilizado como un estimador del riesgo de desarrollar cáncer de mama, ya que la mayoría de los cánceres de mama ocurren posteriores dentro de 5 años del diagnóstico (6).
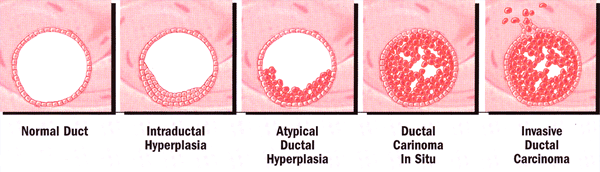
Desarrollo de la hiperplasia ductal a la enfermedad invasiva
Mamográfico de mama Densidad: la densidad de la mama de la mujer puede ser evaluada en una mamografía de rutina y se ha demostrado que se correlaciona con el riesgo de cáncer de mama. El patrón del parénquima mamográfico (densidad de la mama) se refiere a la cantidad de tejido conectivo y glandular en relación con el tejido adiposo de la mama. Dado que los cánceres de mama también se compone de tejido denso, de alta densidad de la mama puede enmascarar tumores en la mamografía, la prevención de su detección precoz. Alta densidad de la mama es también un factor de riesgo para el cáncer de mama, pero puede ser independiente de la exposición a estrógeno o estrógeno-estado del receptor (7). Así, el aumento del riesgo de cáncer de mama asociado con la densidad de la mama también puede ser resultado de factores no estrogénicos, como los niveles de insulina-como el factor de crecimiento, la dieta y / o los factores genéticos y ambientales. La densidad de senos varía significativamente entre las mujeres y puede tener altas (~ 63%) la heredabilidad. Análisis de texturas informatizada de las imágenes mamográficas demostrado que los patrones del parénquima en mujeres de alto riesgo que llevan a mutaciones en el gen BRCA1 o BRCA2 fueron denso, grueso, y tenía menos contraste con una variación de menos locales que los de las mujeres en bajo riesgo de desarrollar cáncer de mama (8) .
Histológico y el análisis citológico para el riesgo de cáncer de mama: la detección de células anormales en la mama se ha demostrado ser un factor de riesgo para el cáncer de mama. Hay una variedad de métodos diferentes para obtener una muestra de la mama. Los métodos tradicionales de recolección de células de la biopsia histológica o análisis citológico - aspiración con aguja fina (PAAF), la punción aspiración del pezón, la biopsia con aguja gruesa, y quirúrgico - todos tienen limitaciones (9). Muestreo al azar con FNA, por ejemplo, es un procedimiento invasivo y con frecuencia los rendimientos de tejido insuficiente para el análisis, en particular en las mujeres mayores. Del mismo modo, los aspirados del pezón con frecuencia contienen células insuficiente. Biopsia con aguja gruesa y la biopsia quirúrgica rendimiento de las células amplia, pero los procedimientos son invasivos que no se realiza sólo para la evaluación de riesgos. Una nueva, el método menos invasivo utilizado para el análisis histológico o citológico es el lavado ductal, que es un procedimiento mínimamente invasivo que extrae el líquido del conducto con un anestésico tópico y se puede realizar en pacientes ambulatorios. Los posibles candidatos para el lavado ductal son mujeres que son estimados por el modelo de Gail para estar en mayor riesgo de desarrollar cáncer de mama.
Breast Imaging: ha sido una herramienta para predecir la probabilidad de diagnosticar el cáncer de mama. La presentación de informes de imagen del pecho y Data System (BI-RADS), desarrollado por el Colegio Americano de Radiología, la evaluación estandarizada de las imágenes para ayudar a determinar el seguimiento apropiado. Anomalías sospechosas - lesiones que requieren intervención (por ejemplo, la biopsia), pero no son necesariamente malignos - se asignan a la categoría 4. En un estudio realizado para evaluar el uso del modelo de Gail como un complemento de la BI-RADS puntuación, las mujeres con lesiones categoría 4 y un 5 años de Gail elevado riesgo (> 1,7%) tuvieron resultados significativamente más malignas en la biopsia que aquellos con lesiones categoría 4 y el riesgo de Gail baja (42% vs 21%, p <.0001; riesgo relativo 1,94). Los investigadores de la teoría de que el método puede ser más útil cuando se aplica a la categoría BI-RADS 3 lesiones, pero el número de mujeres en esta categoría era demasiado pequeña para el análisis (10). El uso de imágenes de mamas como un complemento al modelo de Gail para mejorar la evaluación del riesgo requiere un mayor análisis.
Mejorar el cumplimiento de las recomendaciones:
Según las teorías de comportamiento, la percepción de mayor riesgo aumentaría el uso de análisis, mientras que la percepción de menor riesgo tendría el efecto contrario. Aunque esto es cierto en muchos casos, la cuestión es compleja. Los estudios encontraron que la reducción de una mujer el riesgo percibido no afectó a su intención de obtener una mamografía y pueden tener mayor cumplimiento de las recomendaciones de cribado. El cáncer de mama, los trastornos psicológicos relacionados (por ejemplo, la preocupación grave) se ha asociado con un bajo cumplimiento con las recomendaciones de cribado, incluso entre las mujeres identificadas como de alto riesgo, mientras que la preocupación moderada se asoció con mayor riesgo de detección. Se ha encontrado que la relación entre la preocupación sobre el riesgo de cáncer de mama y la mamografía se asocia con un patrón de U invertida de forma. Las mujeres con niveles moderados de preocupación eran más propensas a hacerse mamografías con regularidad el nivel de los dolores de cabeza fue muy baja o muy alta. Los investigadores de la teoría de que preocuparse graves desencadena la negación y la conducta de evitación, mientras que la vigilancia preocupación moderada y la motivación para utilizar métodos de detección (11). El asesoramiento genético puede proporcionar una evaluación crítica de la historia de la familia para ayudar a determinar la probabilidad de un síndrome hereditario de susceptibilidad al cáncer y la pertinencia de las pruebas genéticas. Las consiguientes recomendaciones clínicas para portador de la mutación necesidad de tener en cuenta la edad del paciente, el deseo de futuros embarazos y la historia médica al prescribir las intervenciones de detección o la cirugía profiláctica (12). Las aplicaciones prácticas de las pruebas genéticas de la susceptibilidad al cáncer tienen la capacidad de reducir la carga de los cánceres hereditarios, salvando vidas, disminuyendo la morbilidad médica, y reducir el estrés psicológico.
Mama y el cáncer de ovario:
Mama y el cáncer de ovario es un síndrome de cáncer hereditario de susceptibilidad. Las características de este síndrome son miembros de familias múltiples con cáncer de mama o cáncer de ovario o de ambos, la presencia de cáncer de pecho y cáncer de ovario en un solo individuo, y la temprana edad de aparición del cáncer de mama (a menudo antes de los 50). La inmensa mayoría de mama y cáncer de ovario se debe a una alteración o mutación en los genes BRCA1 o BRCA2. Estas mutaciones pueden ser heredados de la madre o el padre. Las estrategias actuales para reducir el riesgo de desarrollar cáncer de mama en mujeres con mutaciones BRCA deletéreos conocidos incluyen la vigilancia, la quimioprevención y la cirugía. De vigilancia recomendados incluye el examen clínico de mama cada seis meses, así como tanto en la mamografía anual y anual de detección temprana de cáncer de resonancia magnética de imágenes comienza a la edad de 25 años o antes, sobre la base de aparición más temprana edad en la familia (14). Examen de mamas La resonancia magnética es más sensible para la detección de cáncer de mama que la mamografía, y la combinación de imágenes de resonancia magnética, mamografía, clínicas y tiene la mayor sensibilidad para la detección de cáncer de mama en portadoras de alto riesgo de mutación BRCA. Reducción del riesgo salpingo-ooforectomía reduce el riesgo de cáncer de mama en un 40-70% (13). Esta protección probablemente se produce sólo si los pacientes son premenopáusicas en el momento de la reducción de riesgos salpingooforectomía. Además, los estudios han demostrado portadores de la mutación BRCA1 puede tener menos de un efecto protector de la reducción de riesgos salpingooforectomía sobre el riesgo de cáncer de mama que portadores de la mutación BRCA2 (14).
Es importante que los individuos de alto riesgo de permanecer en contacto con médicos con experiencia en el cuidado de las mujeres en mayor riesgo, habida cuenta de rápido desarrollo de la investigación y el perfeccionamiento de la tecnología de pruebas. Por ejemplo, una prueba de grandes reordenamientos en los genes BRCA1 y BRCA2 se ha desarrollado que puede ayudar a identificar las mutaciones en un pequeño porcentaje de las familias de alto riesgo que previamente arrojaron resultados negativos de estos genes. Una evaluación del riesgo genético es recomendado para pacientes con una mayor probabilidad de aproximadamente un 20-25% de tener una predisposición hereditaria al cáncer de mama y cáncer de ovario. El modelo Gail es una herramienta validada para mujeres de raza blanca que la estimación del riesgo absoluto de una mujer de desarrollar cáncer de mama invasivo en los próximos 5 años en base a los factores de riesgo descritos anteriormente. No hay una herramienta que pueda predecir con precisión que las mujeres tendrá cáncer de mama. Instituto Nacional del Cáncer cáncer de mama herramienta de evaluación del riesgo y una calculadora de riesgo están disponibles en: http://www.cancer.gov/bcrisktool/
Resumen:
Mujeres de 40-49 años deben tener una mamografía cada 1-2 años. Las mujeres mayores de 50 años deben tener una mamografía anual. A pesar de la falta de datos definitivos a favor o en contra de autoexamen de mamas, el autoexamen de mamas (EEB) tiene el potencial para detectar el cáncer de mama palpable y debe ser recomendada. Todas las mujeres deben someterse a exámenes clínicos del seno cada año como parte del examen físico. Cuando una masa no palpable que se percibe en la mamografía de cribado, el paciente debe ser referido a un profesional con experiencia en el diagnóstico de cáncer de mama para que una obra completa de imágenes en marcha se puede realizar. La mamografía es útil en la evaluación de las mujeres que sospechen que tienen una masa de mama que el médico no puede palpar. En tales casos, las imágenes de ultrasonido enfocado puede ser un componente de la evaluación completa de imágenes a cualquier edad. Una masa no palpable puede requerir una biopsia con aguja o biopsia de localización estereotáctica.
Las mujeres pueden beneficiarse de la asesoría y pruebas genéticas si sus antecedentes familiares, entre ellos la edad al momento del diagnóstico y tipos de todos los cánceres (en cualquiera de sus familiares, mujeres y hombres), sugiere un posible patrón autosómico dominante, el cáncer o si una mutación BRCA se ha descubierto en su familia . El asesoramiento genético se abordarán los riesgos y beneficios de la prueba.
Lecturas recomendadas:
- World Health Organization
Screening for Breast Cancer - U. S. National Institutes of Health (NIH)
Breast Cancer - Center for Disease Control and Prevention (CDC)
Breast Cancer Continuing Medical Education Program
Referencias:
- American Cancer Society. Cancer facts & figures 2003. Atlanta (GA): ACS; 2003. (Level II-3)
- Olsen O, Gotzsche PC. Screening for breast cancer with mammography (Cochrane review). In: The Cochrane Library, Issue 4, 2002. Oxford: Update Software (Meta-analysis)
- ACOG Practice Bulletin. Breast Cancer Screening. Number 42, April 2003
- Humphrey LL, Helfand M, Chan BK et al. Breast cancer screening: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2002;137:347-360. (Meta-analysis)
- Fisher B, Costantino JP, Wickerham DL et al. Tamoxifen for prevention of breast cancer. J Natl Cancer Inst 1998;90:1371-1382
- Rivers A, Newman LA. Ductal lavage for breast cancer risk assessment. Surg Oncol Clin N Am 2005;14:45-68
- Kerlikowske K, Shepherd J, Creasman J et al. Are breast density and bone mineral density independent risk factors for breast cancer? J Natl Cancer Inst 2005;97:368-374
- Boyd NF, Dite GS, Stone J et al. Heritability of mammographic density, a risk factor for breast cancer. N Engl J Med 2002;347:886-894
- Vogel VG. Atypia in the assessment of breast cancer risk: implication for management. Diagn Cytopathol 2004;30:151-157
- Tice JA, Cummings SR, Ziv E et al. Mammographic breast density and the Gail model for breast cancer risk prediction in a screening population. Breast Cancer Res Treat 2005;94:115-122
- Quillin JM, Fries D, McClish D et al. Gail model risk assessment and risk perception. J Behav Med 2004;27:205-214
- Karlan BY, Berchuck A, Mutch D. The role of genetic testing for cancer susceptibility in gynecologic practice. Obstet Gynecol 2007;110:155-167
- Kauff ND, Domchek SM, Friebel TM et al. Risk-reducing salpingo-oophorectomy for the prevention of BRCA1- and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study. J Clin Oncol 2008;26:1331-1337. (Level II-2)
- ACOG Practice Bulletin. Hereditary breast and ovarian cancer syndrome. Number 103, April 2009
Publicado: 6 November 2009
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


