Las complicaciones del cáncer de mama Tratamiento quirúrgico y linfedema
WHEC Boletín Práctica Clínica y Gestión de los proveedores de salud. Educación subvención prevista de Salud de la Mujer y el Centro de Educación (WHEC).
Las complicaciones después de una operación puede ser minimizado con la evaluación preoperatoria completa, una técnica meticulosa, hemostasia y cierre de la herida. Además de la norma de evaluación oncológica, la evaluación preoperatoria incluye la evaluación de la condición fisiológica general del paciente, con especial énfasis en la tolerancia de la anestesia, la diabetes no controlada, hipertensión, anemia, coagulopatía, o la dependencia de esteroides. El linfedema es una complicación temida de la cirugía del cáncer de mama. Los pacientes con linfedema grave tiene el brazo crónica, a menudo debilitantes inflamación con dolor resultante, disminución de la función, la disminución de la calidad de vida, y la deformidad cosmética. Debido a su carácter crónico, así como la falta de métodos probados de tratamiento a largo plazo, el desarrollo de linfedema es tal vez la complicación más temida de la cirugía del cáncer de mama para pacientes y cirujanos. El tratamiento eficaz para el linfedema está disponible. El diagnóstico precoz es importante ya que el tratamiento es más eficaz cuando el linfedema se diagnostica en las primeras etapas. Todos los pacientes con linfedema deben tener acceso a un tratamiento de efectividad para esta condición. El linfedema no tiene cura pero puede tratarse con éxito cuando se diagnostican y tratan correctamente.
El propósito de este documento es revisar los enfoques utilizados para el cuidado de la herida después de la mastectomía y las direcciones de las complicaciones encontradas en estos pacientes. La rehabilitación de los pacientes después de la mastectomía produce problemas de diversa complejidad. Fisiopatología, prevención y manejo del linfedema también son discutidos. La mastectomía es una operación segura, con baja morbilidad y mortalidad. Aunque la incidencia de complicaciones postoperatorias es baja, los médicos deben ser conscientes de la morbilidad única de la mastectomía y disección de ganglios axilares. El riesgo de desarrollar linfedema no disminuye con el tiempo, pero es un riesgo para toda la vida. Progresivo del linfedema se complica por infecciones recurrentes, heridas que no sanan, malestar o dolor, dificultad con las tareas diarias, emocional y la angustia social.
Cuidado de la herida después de la mastectomía
Técnica en la operación y cierre de la herida es una parte esencial de la reparación de la herida. Hemostasia meticulosa debe ser confirmada antes del cierre. Aspiración cerrado drenajes deben ser colocados en el sitio de herida de la mastectomía, porque la mayoría de los pacientes desarrollarán un seroma. Preferimos cerrado de drenaje por succión con catéter de la herida de la mastectomía, disponible comercialmente como tubo de Blake (Ethicon) o Jackson Pratt (Baxter) y cada sistema debe ser colocado correctamente en la operación para permitir la colocación superomedial e inferolateral para asegurar la aspiración profunda, depende. Después de que la herida se cierra, el tubo está conectado a asegurar la eliminación de todos los contenidos de la herida (por ejemplo, coágulos, suero). Drenaje por aspiración del catéter, por regla general, es necesario de 5 a 10 días del postoperatorio. Rutinariamente, los catéteres se retiran cuando menos de 30 ml de drenaje seroso o serosanguinolento es evidente por dos años consecutivos intervalos de 24 horas.
La piel se cierra en dos capas con sutura absorbible. Un aderezo ligero, una gasa seca se aplica a la incisión. Vendajes de presión sobre los colgajos de piel disecada son innecesarias y no disminuir la cantidad y la tasa de formación de seroma (1) . En el postoperatorio, la herida es cuidadosamente inspeccionado en cuanto a la adherencia del colgajo, y se anima al paciente a reanudar la actividad preoperatoria. En la mayoría de las circunstancias, el paciente con cáncer de mama pueda comenzar la reanudación gradual de las actividades de pre-quirúrgica. Las mujeres jóvenes suelen recuperar el rango completo de movimiento del brazo y el hombro poco después de la retirada del drenaje, mientras que algunos pacientes mayores pueden requerir intensa (supervisado) de ejercicio durante varios meses antes de alcanzar su nivel anterior de actividad. Visitas domiciliarias de los profesionales de la salud de la Asociación de Enfermeras de Visita (VNA) son de especial interés para la recuperación psicosocial y física del paciente después de la mastectomía. La reconstrucción mamaria es un complemento importante en el tratamiento del cáncer de mama. Las ventajas de la reconstrucción mamaria en términos de calidad de vida están bien documentados (2) . Además, estudios recientes han refutado muchas de las preocupaciones sobre los posibles efectos de la reconstrucción mamaria en la gestión de la cirugía de mama (3) . Por ejemplo, las grandes series han demostrado que la reconstrucción mamaria no modifica el comportamiento biológico del cáncer de mama, no de manera significativa retrasar o interferir con la administración de la quimioterapia adyuvante, y no está asociada con un retraso en el diagnóstico de recurrencia del cáncer de mama (4) . Sin embargo, a pesar de que la reconstrucción mamaria se realiza ahora de manera rutinaria, no hay datos sobre el impacto de la reconstrucción mamaria en el desarrollo de linfedema.
Las complicaciones de la mastectomía
- Infección de la herida: Después de la mastectomía radical modificada, las tasas de infecciones de las heridas van desde 2,8% a 15% (5) . La infección de la herida de la mastectomía o en el brazo ipsilateral puede representar una grave morbilidad en el postoperatorio del paciente y produce discapacidad que puede progresar a finales de postoperatorio linfedema del brazo. La celulitis se ve en el periodo post-operatorio, responde al tratamiento antibiótico en la mayoría de los casos. Cuando la formación de abscesos se produce, se debe intentar que la cultura de la herida por los organismos aeróbicos y anaeróbicos, con inmediata tinción de Gram de las cepas de identificación para documentar la contaminación bacteriana. Los organismos predominantes son el S aureus y S. epidermidis S. Los factores que pueden aumentar el riesgo de infección incluyen la biopsia abierta antes de la mastectomía, aumento de la edad, el drenaje de succión prolongada del catéter, y las alteraciones de los mecanismos de defensa del huésped.
- Seroma: Es una colección de líquido seroso en la cavidad quirúrgica que es clínicamente evidente. Después de la mastectomía, seromas ocurren en el espacio muerto debajo de la elevación de colgajos de piel y representa la complicación más frecuente de la mastectomía, en desarrollo en aproximadamente el 30% de los casos (6) . Con la ablación quirúrgica de la mama, los vasos linfáticos y los tejidos grasos que intervienen son resecadas en bloque, por lo que el sistema vascular y linfático de la glándula se secciona. Por lo tanto, trasudación de la linfa y la acumulación de sangre en el campo operatorio se espera. Técnica quirúrgica debe reducir al mínimo el derrame linfático y trasudación de suero para permitir el cumplimiento rápido de los colgajos de piel a las estructuras profundas sin compromiso del flujo sanguíneo a los colgajos de piel o la axila. El uso de un sistema cerrado de drenaje del catéter de succión en los últimos 20 años ha facilitado en gran medida la reducción de la prolongada colecciones de suero. Los pacientes con un índice de masa corporal (IMC) tienen una mayor tasa de formación de seroma. La incidencia de la formación de seroma también aumenta con la edad (7) . La mayoría de los cirujanos oncológicos recomendar - que permite la movilidad del brazo inmediatamente después de la cirugía, pero demora un ejercicio estructurado de rutina hasta después de los desagües se han eliminado.
- Neumotórax: Es rara complicación, se desarrolla cuando el cirujano perfora la pleura parietal con la disección del tejido extendida o con los intentos de hemostasia para los perforadores de la musculatura intercostal. El neumotórax es más común en los pacientes que se someten a una mastectomía radical después de la eliminación de la musculatura pectoral mayor. Dificultad respiratoria se reconoce en el operativo o el inmediato post-operatorio, períodos y neumotórax se confirma con una radiografía de tórax. La intervención inmediata con el drenaje de toracostomía cerrada en el espacio pleural es esencial tan pronto como neumotórax se verifica.
- Tissue Necrosis: A commonly recognized complication of breast surgery is necrosis of the developed skin flaps or skin margins. La necrosis de tejido: Una complicación comúnmente reconocidos de la cirugía de mama es la necrosis de los colgajos de piel desarrollados o en los márgenes de la piel. Bland y sus colegas observaron una incidencia de 21% para menores y mayores de necrosis de los colgajos cutáneos de la mastectomía con infección de la herida asociados (7) . Desbridamiento local no suele ser necesario en las áreas de menor importancia de la necrosis (<2 cm de la zona). Grandes áreas de parcial o pérdida total del espesor de la piel requieren desbridamiento y, en ocasiones la aplicación de injertos de piel de espesor parcial. Rotación colgajos de piel y tejido subcutáneo compuesto piel puede ser utilizado desde la pared lateral del tórax o de la mama contralateral para cubrir el defecto.
- Hemorragia: Se ha informado como una complicación post-operatoria en el 1% a 4% de los pacientes y se manifiesta por la inflamación excesiva de las aletas de la zona quirúrgica (8) . El reconocimiento precoz de esta complicación es imprescindible. La aspiración del hematoma licuado y establecer la permeabilidad de los catéteres de succión se puede tratar la hemorragia. La aplicación de un vendaje de compresión ligera reforzada con Hansaplast cinta debe disminuir la recurrencia de este evento adverso. Hemorragia grave temprana es lo más a menudo en relación con los perforadores arteriales de los vasos thoracoacromial o arterias mamarias internas. La ligadura de sutura directa es aconsejable. Miller y colaboradores concluyeron que el uso del bisturí eléctrico para el desarrollo de los colgajos de piel en la realización de una mastectomía reduce la pérdida de sangre, sin incurrir en una mayor incidencia de complicaciones de la herida (8) .
- Neuro-vasculares Lesiones Estructuras: La lesión del plexo braquial es una complicación rara de la mastectomía y evitar meticulosa (bisturí frío) disección aguda y sobre el paquete neuro-vascular y de la elaboración de los planos tisulares que son paralelos a la neurilema y la pared la vena axilar para permitir la resección en bloque de las estructuras linfáticas y el tejido graso. La inervación sensorial de la mama se deriva de las ramas cutáneas laterales y anterior de la segunda a través de los nervios intercostales sexto. El paciente normalmente experimenta un dolor moderado en el sitio de la operación, el hombro y el brazo en el postoperatorio inmediato. Debido a la necesidad del desarrollo de solapa amplia, el paciente puede notar hiperestesia y parestesia, así como ocasionales "fantasma" hiperestesia en el sitio de la mastectomía. El síndrome fantasma de mama es una continua presencia sensorial de la mama después de haber sido eliminado. Es un dolor fantasma en el 17,4% de los casos, y, en el 11,8% de los casos y se presenta como una sensación dolorosa no fantasma, como picazón, sensibilidad en el pezón, y de tipo premenstrual molestias en las mamas (9) .
Menos comunes son las lesiones en el nervio toracodorsal y el nervio torácico largo (respiratoria) de Bell. El toracodorsal, o en el nervio subescapular, inerva el músculo dorsal ancho lattissimus en su curso con la toracodorsal (subescapular) los buques y que comúnmente se sacrificaron cuando los ganglios linfáticos que se descubren a participar con metástasis en la disección axilar. Lesión u operación del nervio torácico largo de Bell produce la inestabilidad y la prominencia de la escápula feas ("omóplato con alas"). El paciente sostener este tipo de lesiones a menudo se quejan de dolor en el hombro en reposo y con el movimiento por muchos meses después del procedimiento. Todos los intentos deben hacerse para preservar el nervio, sin embargo, su relación con neoplasia invasora o la extensión ganglionar puede exigir que se sacrificó para asegurar la extensión adecuada en bloque. Los nervios pectoral lateral y medial de los músculos pectoral mayor y la inervación motora a la salida del pectoral menor del plexo braquial para entrar en la cara posterior de estos músculos en la axila proximal. La preservación del pectoral mayor y su función es el objetivo de la mastectomía radical modificada. Por lo tanto el mantenimiento de la integridad de los nervios pectorales medial y lateral es de suma importancia para garantizar el funcionamiento posterior del músculo pectoral mayor.
El linfedema
El linfedema es causado por una anormalidad del sistema linfático que conduce a una acumulación excesiva de líquido de los tejidos linfáticos que se forma, se conoce como líquido intersticial. El estancamiento de la linfa contiene proteínas y restos celulares que causa la hinchazón de los tejidos afectados. La linfa es responsable del transporte de productos químicos esenciales y las células inmunes. El linfedema es la acumulación de líquido rico en proteínas en los tejidos blandos como resultado de la interrupción del flujo linfático. Se presenta con mayor frecuencia en las extremidades, pero también se pueden encontrar en la cabeza, cuello, abdomen, los pulmones y las regiones genitales. En los pacientes después de la mastectomía, linfedema crónico tiene el potencial de convertirse en una condición permanente y progresiva. Si se permite que avance, la afección puede llegar a ser extremadamente resistentes al tratamiento y en la mayoría de los casos no se puede estar libre, ya sea con medios médicos o quirúrgicos. Si no se trata, el linfedema conduce a la inflamación crónica, la infección y el endurecimiento de la piel que, a su vez, se traduce en más daño a los vasos linfáticos y la distorsión de la forma de partes del cuerpo afectadas (11) . El líquido intersticial se puede acumular en cualquier área del cuerpo que tiene el drenaje linfático insuficiente y causar linfedema. El linfedema es una afección que se desarrolla lentamente y una vez presente es generalmente progresiva (12) . El linfedema se divide en dos formas: linfedema primario y secundario del linfedema. Las personas pueden nacer con anormalidades en el sistema linfático. Este tipo de linfedema es la conocida como linfedema primario. Dependiendo de la severidad de la condición, la hinchazón puede estar presente al nacer o pueden aparecer más tarde en la vida. Linfedema primario se asocia con anormalidades en el desarrollo del sistema linfático, puede manifestarse en los recién nacidos (congénita), adolescentes (precoz), o pacientes mayores de 35 años (tarda). linfedema secundario es la forma más común de linfedema. Esto generalmente ocurre después de la cirugía oncológica o la radioterapia. La condición se produce como consecuencia de los daños causados por la enfermedad metastásica con el sistema linfático, después de la radiación, cambios en las estructuras de la piel subyacente, o extirpación quirúrgica de uno o más ganglios linfáticos cuencas. La mayoría de linfedema en los Estados Unidos es el linfedema secundario. Este tipo de linfedema ocurre por daño al sistema linfático, comúnmente del cáncer y su tratamiento, sino también de un traumatismo en la piel, como quemaduras o infecciones (13) . El linfedema después del cáncer de mama ha sido estudiado más, pero el linfedema puede ocurrir como resultado de otros tipos de cáncer, incluido el melanoma, el cáncer ginecológico, cáncer de cabeza y cuello o sarcoma.
Se estima que hasta un 30% -50% de los pacientes que se someten a la disección de los ganglios linfáticos axilares llegar a desarrollar algún tipo de linfedema (10) . La variabilidad en la incidencia de linfedema se debe en parte a la falta de una definición estandarizada (14) . Además, aunque la mayoría de los pacientes que desarrollan linfedema hacerlo dentro de los 3 años de la cirugía, la aparición de linfedema ocurre hasta en un 25% de los pacientes (10) . Además de la hinchazón del brazo medido, muchos pacientes han percibido o hinchazón del brazo subjetiva que es difícil de cuantificar (15) . Avances en el tratamiento del cáncer de mama, especialmente el advenimiento de la biopsia del ganglio centinela (ganglio centinela), han disminuido la incidencia de linfedema. Sin embargo, recientes estudios a largo plazo han demostrado que incluso en pacientes sometidos a ganglio centinela solo, tanto objetiva como subjetivamente mide el linfedema puede ocurrir en el 3% -5% (15)(16) . Por lo tanto, está claro que incluso las perturbaciones menores en los patrones de drenaje axilar que se producen con ganglio centinela en algunos casos puede causar linfedema.
Los factores que contribuyen de linfedema
Seis factores que contribuyen se ha demostrado que influyen en la incidencia de edema braquial después del tratamiento para el cáncer de mama: la terapia de radiación, la obesidad, edad, lugar de la operación, el tipo de incisión y la historia de la infección. Adición de radioterapia se ha demostrado que aumenta la incidencia de linfedema del 20% al 52% (17) . La incidencia de linfedema es menor si en lugar de incisiones transversales oblicuas se utilizan (18) . La extensión de la disección axilar es un factor importante. Limitar la disección axilar de ganglios de nivel I y II y la preservación de los nodos de nivel III y los canales linfáticos colateral alrededor del hombro puede disminuir la incidencia de linfedema agudo y crónico. La tecnología reciente ha introducido el concepto de mapeo linfático y la realización del ganglio centinela en mujeres con cáncer de mama invasivo. Con la hipótesis de que la histología del ganglio centinela refleja la histología de los nodos restantes de la cuenca, información completa estadificación ganglionar puede ser obtenido con una simple biopsia de ganglio linfático de uno o más nodos. Este enfoque puede limitar la posibilidad de linfedema sólo a aquellas mujeres con evidencia histológica de metástasis en la axila.
Linfedema crónico es un problema importante con opciones limitadas de tratamiento (19) . En los Estados Unidos, la causa más común de linfedema es la disección de los ganglios linfáticos axilares del cáncer de mama (19) . La mayoría de los autores clasifican hinchazón del brazo superior a 5 cm desde el inicio / brazo contralateral o como diferencia de volumen de más de 40% desde el inicio como linfedema grave (17)(20) . Linfedema moderado se define como 2.5 cm de circunferencia del brazo aumenta. Algunos autores han definido linfedema leve como las diferencias en las mediciones de brazo que están a menos de 2 cm, pero se asocian con la sensación subjetiva de hinchazón. El uso de la percepción del paciente en la definición del linfedema es importante y es promovida por la Sociedad Americana del Cáncer (ACS). Por lo tanto, pacientes, orientada entrevistas e instrumentos validados para evaluar los síntomas de linfedema se han desarrollado y permiten la combinación de la percepción del paciente y las medidas objetivas (21) . El inicio de la relación del linfedema de la intervención quirúrgica es impredecible y puede ocurrir durante varios años. Series clínicas grandes se han identificado una serie de factores de riesgo de linfedema. Los factores de riesgo más consistentemente identificados incluyen la obesidad, aumento de peso post-operatorio, post-operatorio infecciones del sitio quirúrgico / brazo, y la radioterapia a la axila (22) .
La estadificación del linfedema
Etapa I:
- Se caracteriza por edema depresible y es reversible con la elevación del brazo.
Etapa II:
- Edema ya no es reversible de manera espontánea;
- Desarrollo de edema rico en proteínas;
- La proliferación de tejido fibrótico.
Etapa III:
- Conocida como elefantiasis;
- Inflamación masiva de la extremidad;
- Líquido rico en proteínas;
- Conjuntivo y tejido cicatrizal;
- El endurecimiento de los tejidos dérmicos;
- Papilomatosis.
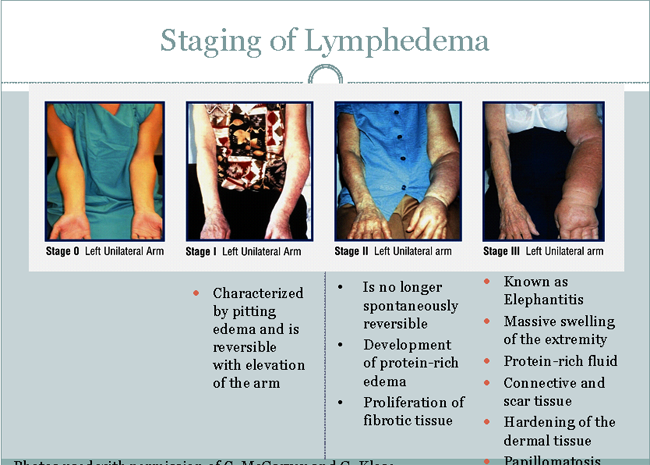
Fig. 1. La estadificación del linfedema
Diagnóstico y Síntomas
El diagnóstico puede establecerse sobre la base de una historia exacta y un examen físico completo. Evaluación de la progresión del edema es esencial en el cuidado postoperatorio de los pacientes. Fotografía en las visitas pre y postoperatorio puede ser muy útil para determinar el inicio y la progresión del linfedema. Mediciones circunferenciales usando puntos de referencia para las marcas óseas también pueden ser una manera práctica y fácil de seguir linfedema paciente. Las diferencias en la medición de la circunferencia entre dos miembros opuestos se observan en múltiples lugares. Estas medidas se suman para cada miembro y la comparación. Si hay una diferencia de más de 10 cm, el linfedema existe. Desplazamiento de agua es el método más preciso de la documentación de los cambios en el edema. Este parece ser el mejor criterio objetivo con el que juzgar el linfedema y la respuesta al tratamiento. Sin embargo, estas técnicas son mucho tiempo y se limitan a las instalaciones que tiene el equipo para realizar el estudio. Técnicas de impedancia bioeléctrica son los desarrollos más recientes para evaluar la acumulación de líquido en las extremidades afectadas. Los síntomas de linfedema crónico suelen ser provocadas por tomar una historia clínica precisa del paciente. Los pacientes se quejan de un aumento general de "llenura" de la extremidad, con el correspondiente "pesadez" y disminución de la capacidad funcional.
Imágenes de tejidos blandos: La resonancia magnética (MRI), tomografía computarizada (TC) y algunos tipos de ultrasonido (EE.UU.) son capaces de detectar la presencia de exceso de líquido en los tejidos (23) . El líquido que se encuentra fuera de las células (extracelular) y también fuera de los vasos (extravascular) se llama líquido de los tejidos o líquido intersticial. El linfedema es un tipo de líquido intersticial acumulación que se produce cuando el líquido no está siendo removido por los vasos linfáticos. MRI, CT y EE.UU. puede mostrar la presencia de líquido intersticial aumentado, pero no se puede saber la causa. Estas técnicas de imagen tienen que ser puestos junto con la historia, examen físico y, a veces las pruebas de diagnóstico por imágenes. Otras condiciones tales como insuficiencia cardiaca o niveles bajos de proteína en la sangre de una enfermedad hepática o la desnutrición pueden causar acumulación de líquido en los tejidos. Resonancia magnética, tomografía computarizada y los EE.UU. puede ser necesaria para determinar la causa del linfedema, especialmente si hay una preocupación de que el linfedema puede ser la consecuencia de un cáncer sin tratar.
Imagen vasos linfáticos: linfoescintigrafía es un estudio de medicina nuclear utilizada para los vasos linfáticos y los ganglios linfáticos de imagen (24) . Radiomarcado partículas de proteína se inyecta debajo de la piel de la zona del cuerpo para ser fotografiado. Por lo general, tecnecio etiquetado coloide de azufre se utiliza. Linfoescintigrafía es preciso para la detección de anomalías del sistema linfático de las extremidades, independientemente de la causa. Esto demuestra el flujo linfático lento o inexistente y las zonas de reflujo (regurgitación). Se puede revelar anomalías de la ingesta de linfa en los ganglios linfáticos con algunas formas de linfedema. Se predice la respuesta al tratamiento y muestra las principales, más grandes vasos linfáticos, la arquitectura básica del sistema linfático y los ganglios periféricos (24) . No muestra los vasos linfáticos profundos de transporte lleva la linfa de los nodos de nuevo a la circulación de la sangre. Linfoescintigrafía identifica anomalías linfáticas en una etapa posterior, después de linfedema se ha producido. Una nueva técnica para los vasos linfáticos de imagen es del infrarrojo cercano Florescence Imaging (NIR), utilizando una sustancia conocida como verde de indocianina (ICG) (25) . El ICG se inyecta en la piel e inmediatamente reflejado con una dinámica (en tiempo real) de la cámara de fluorescencia infrarroja. Con NIR-ICG, incluso los vasos linfáticos muy pequeños pueden ser vistos. Se puede diagnosticar el linfedema y de encontrar anormalidades en una etapa temprana, posiblemente antes de que la inflamación es evidente. Aunque esta técnica es prometedora para el diagnóstico de linfedema, que está actualmente disponible en muy pocos centros, la mayoría de los cuales están involucrados en la investigación.
Medidas de los volúmenes: Medidas de las extremidades (brazos y piernas) el volumen ha sido la forma habitual de detectar el linfedema durante años y han demostrado ser precisos cuando se hace correctamente (26) . El volumen se mide por tres métodos principales: el desplazamiento de medición de cinta, perometry, y el agua. Mediciones de la cinta se toman a intervalos definidos, utilizando fórmulas geométricas para calcular el volumen total. Esta técnica puede ser válida si se hace exactamente de la misma manera cada vez, y es más precisa cuando la misma persona toma las medidas cada vez. Perometry utiliza un escáner de infrarrojos ópticos y electrónicos para calcular el volumen de la parte del cuerpo. Perometry es correcta si la parte del cuerpo se coloca exactamente de la misma manera cada vez y la máquina ha sido calibrada para mayor exactitud. Perometry se ha demostrado que detectar cantidades tan pequeñas como un cambio del 3% en volumen de la extremidad en los sobrevivientes de cáncer de mama seguido en el tiempo (27) . Desplazamiento de agua, el banco "patrón oro" para evaluar el volumen, se utiliza muy poco en estos días debido a sus molestias.
Prueba de la conductancia eléctrica: Espectroscopia de bioimpedancia (BIS) es un método para medir el contenido de agua en los tejidos. Se ha utilizado durante muchos años para evaluar el contenido de agua total de la composición corporal y el cuerpo para la pérdida de condición física y el peso. BIS ya está disponible para medir el líquido intersticial como un componente de evaluación que conduzcan al diagnóstico de linfedema y se ha demostrado para proporcionar datos fiables para ser utilizados en el diagnóstico de cáncer de mama con linfedema relacionado con (28) . BIS se hace pasando un pequeño dolor actual, eléctrica a través de la extremidad y la medición de la resistencia a la corriente (impedancia). La máquina utiliza ciertas frecuencias de la corriente eléctrica para determinar si existe más fluido en comparación con la extremidad contralateral. Esto se hace comparando la diferencia en la resistencia a la electricidad que pasa a través del líquido intersticial en comparación con el líquido intracelular. BIS actualmente se realiza en toda la extremidad ya que la resistencia al flujo de corriente para la técnica estándar se calcula la longitud de la parte del cuerpo. Cuanto mayor sea el contenido de agua en el tejido intersticial, menor será la resistencia (impedancia). BIS no es exacta por adelantado, edema fibroso.
Los cambios en las propiedades biomecánicas de los tejidos: Las medidas de las propiedades biomecánicas de los tejidos son importantes para la investigación. Esperemos que el desarrollo continuado conducirá a mejores herramientas para el uso clínico de manera que los métodos de diagnóstico se incluyen los métodos cuantitativos de la piel y del tejido subcutáneo cambios asociados con el linfedema progresivo. El linfedema hace que la piel afectada y los tejidos subcutáneos se inflame y endurecido (fibrosis). En la actualidad, estos cambios en la piel se documentan mediante un examen físico de la textura de los tejidos, los pliegues de las picaduras, piel ampliada y otras afecciones de la piel, como heridas y papilomas (tumores benignos en la piel en las áreas de linfedema). Los métodos disponibles para medir la textura de la piel y la resistencia cuantitativamente son: dieléctrica constante del tejido y la tonometría (29) .
Importancia de la detección temprana del linfedema
Por lo general, esta afección se diagnostica sólo cuando sea claramente visibles, en los que el tratamiento punto es a menudo ineficaz. El enfoque del programa de detección WHEC Cancer Center es para diagnosticar la enfermedad en su estado subclínico cuando la intervención temprana puede prevenir el desarrollo de signos y síntomas clínicos. La medición de línea de base y mediciones periódicas tras el tratamiento del cáncer de mama es vital para un diagnóstico preciso. La medición toma sólo tres minutos con un perometer - un aparato que emplea la tecnología de infrarrojos para comprobar con exactitud el volumen del brazo. Medición de brazo, que ahora es una parte de la evaluación clínica habitual nos ha ayudado a mejorar la identificación y el tratamiento de la enfermedad y también ha dado lugar a una mayor comprensión de los factores de riesgo involucrados. Las primeras intervenciones como el uso de una manga de compresión durante 12 semanas puede prevenir la progresión de la enfermedad. Las mujeres que progresan a linfedema moderado se gestionan a través de medidas más agresivas como vendaje nocturno masaje y compresión, además de uso de una manga, son beneficiosos. Algunas mujeres experimentan una forma transitoria de la condición, sino que muestran signos de linfedema subclínico, pero no el progreso de los síntomas clínicos. Distinguir los dos grupos es fundamental para garantizar que las mujeres no reciben un tratamiento innecesario (40) . En este estudio, los investigadores han determinado que los sometidos a disección de ganglios linfáticos o radioterapia a los ganglios linfáticos aumenta el riesgo de una mujer de desarrollar linfedema. Hasta el 8% de los pacientes que han biopsia de ganglio centinela y de 20 a 25% de las mujeres con la disección de ganglios linfáticos axilares desarrollan linfedema en algún momento después del tratamiento (40) . La radioterapia adyuvante y la infección postoperatoria aumentar el riesgo de desarrollar linfedema, así como un índice de masa corporal superior a 25.
n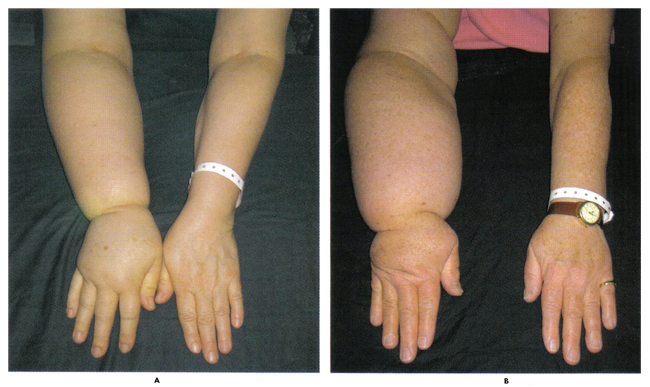
Fig. 2. Una forma potencialmente irreversible de la desfiguración, el linfedema puede obstaculizar la función del brazo y con frecuencia se diagnostica demasiado tarde para que el tratamiento sea efectivo. La foto de arriba las mujeres experimentaron un aumento del volumen del brazo de un 31% (A) y 54% (B).
Opciones de Tratamiento
- Prevención: La mastectomía radical del pasado ha sido sustituido por los procedimientos más conservadores que tienen el potencial para disminuir la incidencia de linfedema. La nueva técnica de mapeo linfático y biopsia del ganglio centinela se compromete a proporcionar información completa estadificación ganglionar con una simple biopsia de ganglio linfático. El linfedema debe ser inexistente después de este procedimiento. La cicatrización primaria crea menos fibrosis que se cicatrización por segunda intención. La atención al detalle y una buena técnica quirúrgica de la disección, la hemostasia adecuada, drenaje por succión, y el cierre sin tensión debería disminuir el riesgo de linfedema postoperatorio. Infección de la herida y sepsis debe ser evitado, lo que sugiere un papel de antibióticos perioperatorios. La terapia de radiación después de la tumorectomía no debe incluir la axila, a menos que la probabilidad de recurrencia en la axila es abrumadora. Si axilas están incluidos en el campo de radiación, la incidencia de linfedema puede ser tan alta como 52% (30) .
- Tratamiento médico: El tratamiento inicial de linfedema crónico secundario deben ser manejados a través de medidas no quirúrgicas. La terapia física, junto con las prendas de compresión o secuencial-gradiente de bombas tipo de compresión, se ha añadido recientemente a la atención integral de pacientes con linfedema crónico. El tratamiento médico debe involucrar un enfoque multidisciplinario en la atención a largo plazo del paciente. Esto incluye la educación del paciente, la enseñanza de ejercicios en casa terapia física, el mantenimiento del rango normal de movimiento y fuerza en la extremidad afectada, y la preservación de movimiento existente.
El linfedema Directrices Lista (30) :
DO:
- Hacer Mantener la piel limpia
- Hacer hidratar la piel
- Hacer elevar las extremidades durante el sueño y viajar
- Se lava con jabones hipoalergénicos y productos de limpieza
- Hacer uso de cuchillas de afeitar eléctrica, no para quitar los pelos
- Hacer uso de detergentes suaves para la ropa
- Mantenga la temperatura constante en la casa
- Tienen una dieta nutricional equilibrada
- ¿Es el tratamiento de las infecciones temprano y durante todo con antibióticos recetados por su médico
- Hacer ejercicio: caminar, nadar, ejercicios isométricos prescrito
- No usar prendas de vestir prescrito y / o vendajes
- Evite cortaduras, quemaduras y picaduras de insectos
- Evite las quemaduras solares - uso de bloqueador solar
- Use ropa holgada
NO:
- NO procedimientos se deben realizar en la extremidad afectada.
- No la extracción de sangre
- No hay inyecciones
- No intravenosa tinte estudios de rayos X
- No acupuntura
- No liposucción
- No hay pruebas de la presión arterial
- No hay ejercicios pesados, traumática, o repetitivas
- No levantar objetos pesados
La terapia descongestiva completa (CDT)
También se le llama combinado, terapia descongestiva compleja o integral (CTD). Es el principal tratamiento del linfedema y se considera "estándar de oro" del tratamiento. CDT se ha demostrado que es efectiva y segura. Se compone de una fase inicial de reducción (Fase I), seguido de una fase de mantenimiento (Fase II) (31) . En la Fase I, los objetivos principales son reducir el tamaño de la parte afectada y la mejora de la piel. Después de la Fase I, la persona con linfedema tiene que seguir en la Fase II, en curso, individualizado de auto-gestión para la eliminación para asegurarse de que los logros de la Fase I se mantienen a largo plazo. Componentes del CDT son: drenaje linfático manual, de varias capas, de poca elasticidad vendaje de compresión, ejercicio linfático, cuidado de la piel, la educación en el linfedema de auto-gestión, y las prendas elásticas de compresión. Efectos de la CDT son: disminuir la hinchazón, drenaje aumentar la linfa de las áreas congestionadas, reducir la fibrosis de la piel y mejorar la condición de la piel, mejorar el estado funcional del paciente, aliviar las molestias y mejorar la calidad de vida, reducir el riesgo de celulitis y Stewart-Treves Síndrome , una forma rara de angiosarcoma.
En condiciones óptimas, la Fase I CDT se realiza todos los días (5 días / semana) hasta que la reducción del volumen de líquido ha alcanzado una meseta, que puede durar de 3 a 8 semanas (31) . Algunos pacientes pueden tener buenos resultados de CST con modificaciones de la frecuencia y la duración del tratamiento. CDT frecuencia y la duración debe ser individualizada para producir la mayor reducción de la inflamación y mejora de la condición de la piel en el menor período de tiempo. A la finalización de la Fase I CDT, la persona con linfedema se configura en un programa de auto-gestión que incluye la auto-drenaje linfático (a veces llamado drenaje linfático simple), ejercicios en casa linfático, un régimen de cuidado de la piel y las prendas de compresión o vendajes que el individuo aprende a aplicar. Algunas personas pueden requerir medidas adicionales con velcro, prendas especializadas de la construcción de espuma, y los dispositivos de compresión neumática. II fase de mantenimiento debe ser monitoreado y cambiarse periódicamente, así como el tratamiento de cualquier otra enfermedad crónica. Las prendas de compresión debe ser reemplazado cada 4-6 meses para ser efectivo. Requiere equipo especializado de mantenimiento y reemplazo de acuerdo con las directrices de los fabricantes. Fase II CDT y el control médico periódico son esenciales para el éxito a largo plazo del tratamiento del linfedema. Los diuréticos son de un mínimo de ayuda en el tratamiento del linfedema crónico como resultado de la cirugía oncológica o la diseminación metastásica de la enfermedad. Las bombas de compresión se está convirtiendo rápidamente en un factor importante en el manejo médico de los pacientes con linfedema crónico. Los investigadores se han centrado recientemente la atención en recrear los efectos beneficiosos del masaje a través de medios mecánicos o de compresión, lo que lleva al desarrollo de dispositivos de compresión. Estas máquinas de compresión se basan en dos principios básicos. El primero es el sistema de compartimiento de una sola célula proporcionar la presión absoluta. Estos dispositivos ofrecen ninguna dirección para el transporte de líquidos, lo cual ocasiona algún reflujo de líquido linfático. Los dispositivos de segunda generación son multi-celular basada en los sistemas de compresión secuencial de la extremidad. Proporciona compresión a la misma presión en cada sección de la prenda de distal a proximal. Sin embargo, esto no quiere imitar a las actividades normales muscular y vascular de la extremidad. Pocos fármacos se están estudiando para el tratamiento del linfedema crónico. Benzopironas puede disminuir el volumen total de edema de alto valor proteico de concentrado por proteolisis estimulante. Venalot, un benzopireno es una droga que rompe las moléculas grandes de proteínas, lo que facilita la absorción de las proteínas en el sistema vascular a nivel de los capilares (32) .
Terapia de compresión neumática intermitente (IPC)
IPC, también conocida como terapia de compresión de la bomba, puede ser útil en algunos pacientes, como complemento de la Fase I CDT o un componente necesario de un programa en casa con éxito la Fase II CDT (33) . Bombas aceptable debe tener aparatos (prendas de vestir de la bomba) con múltiples cámaras y tener un suministro de presión secuencial con las cámaras de compresión en un patrón específico determina individualmente para el diagnóstico del paciente y el patrón de linfedema. Las presiones recomendadas para la bomba se extienden generalmente 30 a 60 mmHg, a pesar de las presiones menores o mayores pueden ser indicados. En general, las presiones más bajas se consideran más seguros, pero la presión tiene que ser individualizado para el diagnóstico del paciente y la condición de la piel. La duración de cada tratamiento es generalmente una hora. IPC no es un "stand alone" del tratamiento. Se utiliza junto con el CDT de mantener el control del linfedema en el hogar estándar. Para mantener el control del edema, una prenda de compresión o vendajes de poca elasticidad, se deben usar entre los tratamientos de la bomba y también cuando IPC se suspende el tratamiento. Pacientes que están siendo considerados para IPC debe ser evaluado por un médico o proveedor de salud con experiencia en el linfedema. Es importante para asegurar una selección segura de que el dispositivo correcto y lo apropiado de la CIP. La receta debe incluir la intensidad de la presión y el patrón de presión que se necesita, teniendo en cuenta varios aspectos de la situación del paciente, incluyendo la determinación de la necesidad de presión programable para el tratamiento de áreas de fibrosis, el tratamiento de la dirección de las úlceras, y ajuste para el nivel de dolor del paciente y la sensibilidad de la piel (34) . Si la inflamación del tronco, el pecho o los genitales está presente, el médico debe determinar si una bomba que provee aparatos para el tratamiento de esas áreas es necesario o si el paciente puede controlar la inflamación del tronco a través del drenaje linfático manual o auto-prendas de vestir. Si una bomba con archivos adjuntos extremo sólo se utiliza, una estrecha vigilancia debe instituirse para detectar un aumento del edema o fibrosis (duro) tejido por encima de la manga dispositivo, llamado anillo fibroscelerotic. Si esto ocurre, se debe considerar la posibilidad de utilizar un dispositivo que trata el tronco, además de las extremidades. Además, el médico o proveedor de salud debe evaluar el impacto de otras condiciones médicas que normalmente se consideran contraindicaciones para la terapia de compresión neumática, incluyendo la infección aguda, severa enfermedad vascular arterial, flebitis aguda vena superficial o profunda (inflamación o coagulación), el cáncer recurrente en la zona afectada, o insuficiencia cardiaca descompensada congestiva.
Tratamiento quirúrgico
Cirugía para el linfedema no es curativo, sino que se ha utilizado en circunstancias específicas para el control de una enfermedad grave. Circunstancias en las que puede considerar la cirugía son: la reducción del peso de la extremidad afectada, lo que minimiza la frecuencia de los ataques inflamatorios, mejorar la apariencia estética, o colocar la extremidad en la ropa. El tratamiento quirúrgico debe ser instituido para pacientes en los que las modalidades médicas anteriores han fracasado o para aquellos que han tenido complicaciones a largo plazo. Hay varios tipos de procedimientos quirúrgicos disponibles que se han utilizado para el linfedema: (a) las operaciones de escisión, incluyendo cirugía reductora y la liposucción, (b) las transferencias de los tejidos, y (c) la reconstrucción microquirúrgica linfática. Estudios previos han demostrado que las infecciones de heridas e infecciones en el brazo ipsilateral son hechos significativos de riesgo para el desarrollo de linfedema. Muchos médicos suponen la reconstrucción mamaria inmediata de aumentar el riesgo de linfedema como consecuencia de un mayor potencial para la infección del sitio quirúrgico. En esta serie (35) , la reconstrucción inmediata no se asoció con mayor riesgo de infección. Además, los pacientes que tenían infecciones no tienen un mayor riesgo de linfedema. Esta última observación debe ser interpretado con cautela. Sin embargo, ya que sólo un pequeño número de pacientes de la serie actual de las infecciones con complicaciones, lo que limita el poder estadístico. En conclusión, el estudio ha demostrado que la reconstrucción mamaria después de una mastectomía con expansor tisular no aumenta el riesgo de linfedema. Esta información es importante para asesorar al paciente.
Citorreducción: Se elimina el tejido conjuntivo duro y cualquier grandes pliegues de tejido graso asociado a la parte del cuerpo afectada por el linfedema (36) . Los posibles riesgos de esta cirugía incluyen la hospitalización prolongada, mala cicatrización de heridas, daños en los nervios o pérdida, cicatrices importantes, la destrucción de los vasos linfáticos que quedan en esa parte del cuerpo, pérdida de la función del miembro, el retorno de la inflamación, los resultados estéticos pobres, y la disminución de la calidad de la vida. Después de la operación, las prendas de compresión todavía son necesarias para el mantenimiento de la extremidad y deben ser usados de por vida debido a los nódulos linfáticos cicatrización de estas cirugías y la insuficiencia linfática. La liposucción para el linfedema es similar, pero no exactamente de la misma, como la liposucción cosmética. El riesgo de la liposucción incluyen sangrado, infección, pérdida de la piel, sensación anormal (tales como entumecimiento, hormigueo, "alfileres y agujas" sentimiento), y regresar el linfedema.
Reconstrucción microquirúrgica linfático: Hay nuevas características de micro-técnicas quirúrgicas que actualmente se está intentando utilizar ya sea venoso linfático-shunts (LVSs) o linfática, la anastomosis venosa (LVA). Estos procedimientos permiten una salida de líquido linfático en la circulación venosa. Que se llevan a cabo en conjunto con las extremidades fasciotomías múltiples y pueden mejorar el drenaje linfático a través de los músculos y la circulación linfática profunda. Las complicaciones incluyen la tromboflebitis y linfangitis (37) . Los pacientes con fibrosis intersticial difusa, la opción más tradicional de Linfangiectomía superficial total (Servelle) o Linfangiectomía superficial parcial (Kondoleon) es recomendado. Una técnica de microcirugía alternativa descrita por Campisi, Boccardo, y Tacchella implica la realización de interposición autóloga linfático-venosa-linfática (LVL) anastomosis. Este procedimiento constituye una alternativa a LVSs directo y se basa en la abundancia de afluentes venosos de gran calibre. La anastomosis LVL consiste en la inserción de los injertos autólogos suficientemente grande y larga venosa entre colectores linfáticos por encima y por debajo del sitio de la obstrucción al flujo linfático. Las contraindicaciones para este procedimiento son la hiperplasia de ganglios linfáticos o aplasia y destrucción extensa de los colectores linfáticos superficiales y profundos. La reducción de volumen de la extremidad se ha informado de una serie de estudios preliminares se han hecho, pero no hay estudios a largo plazo de la eficacia de estas técnicas (38) .
Tratamientos complementarios, integradora y alternativa
Un número de tratamientos prometedores se han reportado, pero aún no han sido sometidos a una rigurosa investigación suficientes para recomendar el estándar de cuidado. Estos tratamientos incluyen láser frío, estimulación eléctrica, la terapia vibratoria, la terapia de oscilación, endermologie y aqua-terapia linfática (39) . Todas estas técnicas se realizan en combinación con los componentes de la CDT. La acupuntura ha demostrado ser útil para algunos síntomas de cáncer y su tratamiento, incluyendo la fatiga, sofocos, dolor muscular o articular, la neuropatía y las náuseas. No hay estudios rigurosos sobre el uso de la acupuntura para tratar el linfedema o el uso de la acupuntura en las extremidades, linfedema (39) . Trampolines reboteador ha sido defendida por algunos para tratar el linfedema, pero no hay estudios publicados sobre este tratamiento. El rebote es un buen ejercicio, pero no se sabe que es superior a otras formas de ejercicio aeróbico en pacientes con linfedema. Debido a las posibles interacciones de los suplementos naturales con los medicamentos recetados y otros efectos secundarios negativos, los pacientes deben consultar con su médico o proveedor de salud antes de tomar cualquier suplemento natural.
Resumen
Un conocimiento exacto de la fisiología y fisiopatología del linfedema es necesario comprender la lógica de las técnicas de tratamiento disponibles. Una evaluación precisa del grado de deterioro debe ser establecida antes de iniciar cualquiera de atención a corto o largo plazo. Aunque la intervención quirúrgica y el tratamiento se han intentado en el pasado, el estándar de atención ahora es un tratamiento médico conservador. Un enfoque multidisciplinario es necesario para maximizar los regímenes de tratamiento disponibles. Cirujanos, enfermeras, fisioterapeutas y terapeutas ocupacionales juegan un papel activo en el cuidado de pacientes crónicos de linfedema. Educación adecuada del paciente y la instrucción en el auto-cuidado son de suma importancia en el cuidado a largo plazo de los pacientes. Un enfoque realista para el cuidado a largo plazo de esta enfermedad junto con el apoyo terapéutico y emocional puede garantizar una vida productiva y menos debilitante para los pacientes con linfedema crónico extremo. Actualmente no hay criterios estandarizados para definir el linfedema. La gran mayoría de series clínicas estudiar el linfedema han utilizado medidas de brazo a distintas distancias proximal y distal al olécranon. Expansor de tejido reconstrucción mamaria en pacientes sometidos a ganglio centinela o ganglio centinela y disección de ganglios linfáticos axilares no aumenta el riesgo de desarrollar linfedema medida o percibida. Tratamiento del linfedema debe llevarse a cabo sólo después de una evaluación diagnóstica completa que se ha hecho de acuerdo a las pautas aceptadas por profesionales calificados. CDT ha demostrado ser eficaz en un gran número de estudios de casos que demuestran la reducción de las extremidades volumen de 50 a 70% o más, mejorar la apariencia de la extremidad, reducción de los síntomas, mejorar la calidad de vida, y menos infecciones después del tratamiento. Incluso las personas con linfedema progresivo de 30 años o más, a partir CDT se ha demostrado que responder. Todas las intervenciones para el linfedema debe tener el objetivo de inducir y mantener la reducción de volumen, la prevención de complicaciones médicas, mejorando la condición de la piel, reducción de la infección, la mejora de la adherencia del paciente, y mejorar el confort y la calidad de vida.
Reconocimiento: Un agradecimiento especial al Dr. Steven M. Schönholz, Director Médico del Centro de Cáncer de Mama en el Mercy Medical Center, Springfield, MA (EE.UU.) la opinión de expertos y la asistencia en la preparación del manuscrito.
Referencias
- O'Hea BJ, Ho MN, Petrek JA. External compression dressing versus standard dressing after axillary lymphadenectomy. Am J Surg 1999;177:450-455
- Elder EE, Brandber Y, Bjorklund T, et al. Quality of life and patient satisfaction in breast cancer patients after immediate breast cancer reconstruction: a prospective study. Breast 2005;14:201-208
- McCarty CM, Pusic AL, Sclafani L, et al. Breast cancer recurrence following prosthetic, postmastectomy reconstruction: incidence, detection, and treatment. Plast Reconstr Surg 2008;121:381-388
- Howard MA, Polo K, Pusic AL, et al. Breast cancer local recurrence after mastectomy and TRAM flap reconstruction: incidence and treatment options. Plast Reconstr Surg2006;117:1381-1386
- Morrow M, Jagsi R, Alderman AK, et al. Surgeon recommendations and receipt of mastectomy for treatment of breast cancer. JAMA 2009;302:1551-1556
- Vinton AL, Traverso LW, Jolly PC. Wound complications after modified radical mastectomy compared with tylectomy with axillary lymph node dissection. Am J Surg 1991;161:584-589
- Banerjee D, et al. Obesity predisposes to increased drainage following axillary node clearance: a prospective audit. Ann R Coll Surg Engl 2001;83:268-272
- Miller PJ, et al. Scalpel versus electrocautery in modified radical mastectomy. Am Surg 1988;54:284-293
- Kroner K, et al. Long-term phantom breast syndrome after mastectomy. Clin J Pain 1992;8:346-354
- Petrek JA, Senie RT, Peters M, et al. Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis. Cancer 2001;92:1368-1377
- Foldi E, et al. The science of lymphedema bandaging in Caine, S. Editor. European Wound Management Association (EWMA). Focus Document: Lymphedema Bandaging in Practice. London: MEP Ltd, 2-4, 2005
- Lawenda B, et al. Lymphedema: A primer on the identification and management of chronic condition in oncologic treatment. Cancer Journal for Clinicians 2009:59:8-24
- Pillar N. Phlebolymphoedema/chronic venous lymphatic insufficiency: an introduction to strategies for detection, differentiation and treatment. Phlebology 2009;24:51-55
- Armer JM, Stewart BR. A comparison of four diagnostic criteria for lymphedema in a post-breast cancer population. Lymphat Res Biol 2005:3:208-217
- Mclaughlin SA, Wright MJ, Morris KT, et al. Prevalence of lymphedema in women with breast cancer 5 years after sentinel lymph node biopsy or axillary dissection: patient perceptions and precautionary behaviors. J Clin Oncol 2008;26:5220-5226
- Mclaughlin SA, Wright MJ, Morris KT, et al. Prevalence of lymphedema in women with breast cancer 5 years after sentinel lymph node biopsy or axillary dissection: objective measurement. J Clin Oncol 2008;26:5213-5219
- Segerstrom K, et al. Factors that influence the incidence of brachial edema after treatment of breast cancer. Scand J Plast Reconstr Surg Hand Surg 1992;26:223-229
- Cody HS III. The learning curve for sentinel lymph node biopsy in breast cancer. Arch Surg 2000;135:605-606
- Soran A, D'Angelo G, Begovic M, et al. Breast cancer-related lymphedema -- what are the significant predictors and how they affect the severity of lymphedema? Breast J 2006;12:536-543
- Sener SF, Winchester DJ, Martz CH, et al. Lymphedema after sentinel lymphadenectomy for breast carcinoma. Cancer 2001;92:748-752
- Armer J, Fu MR, Wainstock JM, et al. Lymphedema following breast cancer treatment, including sentinel lymph node biopsy. Lymphology 2004;37:73-91
- Hinrichs CS, Watroba NL, Rezaishiraz H, et al. Lymphedema secondary to postmastectomy radiation: incidence and risk factors. Ann Surg Oncol 2004;11:573-580
- Astrom K, et al. Imaging of primary, secondary and mixed forms of lymphedema. Acta Radiol 2001;42:409-416
- Szuba A, et al. Diagnosis and treatment of concomitant venous obstruction in patients with secondary lymphedema. J Vasc Intervent Radiol 2003;13:799-803
- Rasmussen J, et al. Lymphatic imaging in humans with Near-Infrared Fluorescence. Curr Opin Biotechnol 2009;20:74-82
- Hayes S, et al. Comparison of methods to diagnose lymphedema among breast cancer survivors: 6 month follow up. Br Ca Res Treat 2005;89:221-226
- Zuther JE. Lymphedema Management: The Comprehensive Guide for Practitioners. 2nd ed. New York, NY: Thieme; 2009
- Mayrovitz H. Suitability of single tissue dielectric constant measurements to assess local tissue water in normal and lymphedematous skin. Clin Physiol Imaging 2009;29:123-127
- Mayrovitz H. Assessing lymphedema by tissue indentation force and local tissue water. Lymphology 2009;42:88-98
- Bland & Copeland. The Breast: Comprehensive Management of Benign and Malignant Disorders. 3rd edition, Volume two. Pp 969; 2004. Publisher: Saunders; an imprint of Elsevier
- Mayrovitz HN. The standard of care for lymphedema: current concepts and physiological considerations. Lymphat Res Biol 2009;7:101-108
- Casley-Smith J, Morgan R, Piller N. Treatment of lymphedema of the arms and legs with 5,6-benzo- [alpha]-pyrone. N Engl J Med 1993;329:1158-1164
- Ridner S, et al. Home-base lymphedema treatment in patients with cancer-related lymphedema or non-cancer-related lymphedema. Oncol Nurs Forum 2008;35:671-680
- Olszewski W. Anatomical distribution of tissue fluid and lymph in soft tissues of lower limbs in obstructive lymphedema-hints for physiotherapy. Phlebolymphology 2009;16:283-289
- Avraham T, Daluvoy SV, Riedel ER, et al. Tissue expander breast reconstruction in not associated with an increased risk of lymphedema. Ann Surg Oncol 2010;17:2926-2932
- Salgado CJ, Sassu P, Gharb BB, et al. Radical reduction of upper extremity lymphedema with preservation of perforators. Ann Plast Surg 2009;63(2):302-306
- Campisi C, et al. Lymphatic microsurgery for the treatment of lymphedema. Microsurgery 2006;26(1):65-69
- Narushima M, et al. The intravascular stenting method for treatment of extremity lymphedema with multiconfiguration lymphaticovenous anastomosis. Plast Reconstr Surg 2010;125:935-943
- National Lymphedema Network. Position Statement of the National Lymphedema Network. http://www.lymphnet.org/lymphedemaFAQs/positionPapers.htm Accessed 15 July 2011
- Ancukiewicz M, et al. Standardized method for quantification of developing lymphedema in patients treated for breast cancer. Int J Radiat Oncol 2011;79(5):1436-1443
Publicado: 15 August 2011
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


