Toxoplasmose: Perinatal infection parasitaire
WHEC Bulletin de pratique et de directives cliniques de gestion pour les fournisseurs de soins de santé. La concession éducative a fourni par Women's Health and Education Center (WHEC).
Beaucoup d'infections parasitaires sont associés à des conséquences importantes de la mère et du foetus s'il a été acquis pendant la grossesse. En général, les infections périnatales ont des conséquences plus graves du foetus quand ils se produisent au début de la gestation, parce que d'abord les infections trimestre mai perturber l'organogenèse. Infections Deuxième et troisième trimestre peut provoquer des troubles neurologiques ou des troubles de croissance. Toxoplasma gondii tire son nom spécifique de l'gondii, un rongeur d'Afrique du Nord à partir de laquelle ce protozoaire fut isolé en 1908. La distribution de l'organisme est omniprésent. Gondii T possède la capacité de traverser les lignes d'espèces et d'établir non seulement l'infection chez les animaux domestiques de l'homme, mais dans l'homme lui-même. Toxoplasma existe dans la nature sous trois formes, le trophozoïte, le kyste et l'oocyste. Le plus important mode de transmission de l'infection à l'homme par ingestion de viande mal cuite contenant des organismes enkystée. L'infection humaine se produit lorsque les viandes infectées est ingéré ou lorsque les aliments sont contaminés par des excréments de chat, en passant par les mouches, les cafards, ou les doigts. Les taux d'infection sont les plus élevés dans les zones de mauvaises conditions d'hygiène et des conditions de promiscuité extrême. Chats errants et des chats domestiques qui mangent de la viande crue sont plus susceptibles de véhiculer le parasite. Le kyste est détruit par la chaleur. Un chat sensibles dépourvue d'anticorps anti-T gondii sera infecté après l'ingestion d'aliments contenant des organismes enkystées et excrètent des oocystes pendant plusieurs semaines. Environ 50% des félins par la suite contesté par l'alimentation des kystes à nouveau excrètent des oocystes, en indiquant la probabilité qu'un chat mai être infectieux plusieurs fois au cours d'une vie. Ces chats qui chassent ou manger de la viande crue en contaminant par leur excrétion fécale des oocystes de mai, constituent un risque potentiel de patientes enceintes.
Le but de ce document est de décrire le mode de transmission de la toxoplasmose, les effets de la mère et du ftus, et d'offrir des lignes directrices pour le counseling et de gestion pendant la grossesse. Les infections parasitaires sont associés à des conséquences importantes de la mère et du foetus s'il a été acquis pendant la grossesse. Toxoplasmose congénitale et la prévention sont également discutés dans cette revue. Les femmes enceintes qui contractent la toxoplasmose devrait être traitée. Traitement des femmes enceintes atteintes de toxoplasmose aiguë réduit mais n'élimine pas le risque d'infection congénitale.
Épidémiologie:
La toxoplasmose est causée par le parasite intracellulaire Toxoplasma gondii. Gondii T existe sous plusieurs formes: un trophozoïte, qui est la forme invasive, et d'un kyste ou un oocystes, qui sont des formes latentes. Le cycle de vie de Toxoplasma T est dépendante des chats sauvages et domestiques, qui sont le seul hôte de l'oocyste. L'oocyste est formé dans l'intestin du chat et ensuite excrétés dans les selles. Mammifères, comme les vaches, ingèrent les oocystes, qui est perturbée dans l'intestin de l'animal, en libérant le trophozoïte envahissantes. Le trophozoïte est ensuite diffusée dans tout le corps, formant finalement kystes dans le cerveau et les muscles. L'infection humaine est acquise par des kystes consommant de la viande insuffisamment cuite d'animaux infectés, par la contamination de l'insecte de la nourriture, par contact avec des oocystes provenant des selles des chats infectés (le seul hôte définitif), ou par contact avec du matériel infecté d'insectes dans le sol (1) . L'infection par T gondii est généralement asymptomatique, mais après une incubation de 5-18 jours, certains des symptômes non spécifiques mai se produire. Environ 40 à 50% des adultes aux Etats-Unis ont des anticorps à cet organisme, et la prévalence des anticorps est plus élevé dans les populations socio-économiques inférieurs. La fréquence de séroconversion pendant la grossesse est de 5%, et environ 3 à 11.000 enfants montrent des signes d'infection congénitale. Toxoplasmose congénitale cliniquement significatif se produit dans environ 1 en 8000 grossesses. La toxoplasmose est plus fréquente en Europe occidentale, notamment en France, vraisemblablement en raison de la pratique dans ce pays de manger de la viande saignante ou crue. Plus de 80% des femmes en âge de procréer à Paris, ont anticorps à T gondii, l'incidence de la toxoplasmose congénitale est environ deux fois plus fréquent que dans les Etats-Unis (2).
Environ 20-25% des femmes en âge de procréer dans les États-Unis présentent des signes sérologiques d'une infection antérieure T gondii. Bien que la prévalence de l'infection augmente avec l'âge avant, à aucun moment ne l'atteindre par l'incidence élevée observée pour une population comparable dans certains pays tropicaux et en France. Aux États-Unis, 2-6 femmes pour 1.000 femmes séro-sensibles fera l'acquisition de l'infection pendant la grossesse. Environ un tiers des femmes qui acquièrent la toxoplasmose durant la grossesse transmettre le virus à leur progéniture. Le plus tard dans la gestation infection maternelle est acquise, plus la probabilité de l'implication du foetus. Quand l'infection se produit le premier trimestre de la grossesse, environ 14% de la descendance sera infectée; les chiffres relatifs à une infection acquise au cours des deuxième et troisième trimestres sont 29% et 59% respectivement. Plus tôt l'infection survient pendant la grossesse, le plus sévère de la maladie se trouve dans le nouveau-né. Presque tous les nourrissons infectés nés de mères qui contractent l'infection pendant le troisième trimestre sera sembler normaux à la naissance et seulement quelques mois ou années plus tard de développer toutes les manifestations cliniques de l'infection.
Manifestations cliniques:
L'organisme ingéré envahit à travers l'épithélium intestinal hématogène et se répand dans tout le corps. Réplication intracellulaire conduit à la destruction des cellules. Les manifestations cliniques de l'infection sont le résultat direct des lésions organiques et de la réponse immunologique à la suite de la parasitémie et la mort cellulaire. Host immunité est principalement médiée par les lymphocytes T (3). La plupart des infections chez les humains sont symptomatiques. Même en l'absence de symptômes, cependant, les patients mai avoir une preuve d'implication multi-organe, et la maladie clinique peut suivre une longue période d'infection asymptomatique. Toxoplasmose symptomatique se présente habituellement comme une maladie semblable à la mononucléose. Contrairement à l'infection chez l'hôte immunocompétent, la toxoplasmose peut être une infection dévastatrice chez le patient immunodéprimé. Parce que l'immunité aux gondii T est à médiation cellulaire, les patients avec une infection du virus de l'immunodéficience humaine et ceux traités avec un traitement immunosuppresseur chronique après transplantation d'organes sont particulièrement sensibles à l'infection ou réactivé. Chez ces patients, le dysfonctionnement du système nerveux central est la manifestation la plus fréquente d'infection. Appréciation comprennent généralement des encéphalites, méningo-encéphalite, et des lésions de masse intra-cérébrale. Pneumopathie, myocardite, et une lymphadénopathie généralisée se produisent aussi fréquemment.
Le plus souvent, la toxoplasmose présente comme une adénopathie cervicale asymptomatique, les symptômes se produisent dans seulement 10-20% des cas adultes. Les autres symptômes comprennent la fièvre, des malaises, des sueurs nocturnes, myalgies et une hépatosplénomégalie. Parasitémie peut survenir après l'infection, qui chez les femmes enceintes peuvent le placenta semences et causer une infection ftale ultérieures. La transmission congénitale de Toxoplasma T dépend du moment de l'acquisition de l'infection maternelle. Le plus tard dans la gestation que l'infection se produit, la transmission est bien plus probable de se produire. Le taux d'augmentation de la transmission verticale de 10% à 15% dans le premier trimestre, à 25% au deuxième trimestre, et à plus de 60% au troisième trimestre (2). Sein de la population obstétricale, la manifestation la plus communément reconnue de la toxoplasmose aiguë est une adénopathie. Mai il être le seul signe de présenter ou mai il être une réponse fébrile associé. L'élargissement nodale mai focalement associer les régions cervicale, supraclaviculaire ou inguinale, et est souvent unilatérale. Biopsie de nodules, de concert avec l'absence de lymphadénite significative, les comptes de l'entreprise, la non-soumission, une hypertrophie des ganglions lymphatiques fréquemment observées. Avec plus avancé de la maladie, la fatigue est le symptôme le plus commun présentant l'infection dans plus sévère. Il mai être associés à des maux de tête, dépression mentale, des myalgies et un peu de fièvre intermittente. Une polyarthrite migrateurs et les différents types d'éruptions principalement maculaire ont également été décrites. Dans de rares cas, la douleur abdominale secondaire à une atteinte des ganglions lymphatiques mésentériques mai être le principal grief présenté. Les manifestations les plus sévères de la maladie systémique sont une myocardite, méningo-encéphalite, ou les deux.
Diagnostic:
Le diagnostic de la toxoplasmose chez la mère peut être confirmée par des méthodes sérologiques et histologiques. Gondii T est le plus facilement identifiés dans lymphatiques ou des tissus du cerveau. Préparations histologiques peuvent être examinés par microscopie photonique et électronique. Pour microscopie optique, les échantillons doivent être badigeonnés à l'une ou l'autre de Giemsa ou les taches de Wright (4). La caractéristique principale de ces histologique des ganglions lymphatiques est marquée une hyperplasie des cellules du réticulum. Au microscope, l'architecture nodale est assez bien conservé. La triade classique de la maladie, qui, toutefois, n'est pas présent dans tous les cas, est constitué par (une hyperplasie) a marqué folliculaire, associée à une activité mitotique intense et la phagocytose des débris nucléaires, (b) granulomes restreint composé presque exclusivement de cellules épithélioïdes , situé dans les follicules hyperplasiques et la périphérie, empiétant sur leurs marges et de flou, et (c) la distension du sinus marginal et par les cellules corticales MONOCYTOID B. Une autre caractéristique est la présence immunoblastes et des plasmocytes dans les cordons médullaires (5). Variations sur le thème incluent la présence dans les granulomes de la nécrose ou plus de cellules géantes de Langhans occasionnelle ».
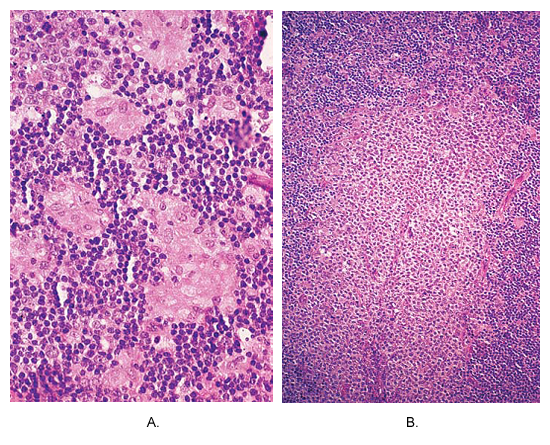
Toxoplasmose du ganglion lymphatique. (A) non small-caséeuse granulomes composé de cellules épithélioïdes sont situés à la périphérie du follicule hyperplasiques. Cette image est quasi pathognomonique de cette maladie. (B) une zone de B MONOCYTOID massive hyperplasie des cellules.
Fluides Isolement de T gondii dans le sang ou l'organisme établit que l'infection est aiguë, les tests sérologiques cependant pour la détection d'anticorps spécifiques à gondii T est la principale méthode de diagnostic. Après une infection aiguë, les anticorps IgM apparaissent tôt et atteignent des niveaux maximum dans 1 mois. Anticorps IgG apparaissent après anticorps IgM sont détectables dans quelques semaines après l'infection, et de conférer l'immunité. À la fois des titres élevés d'anticorps IgG et IgM mai persister pendant des années. Chez l'adulte immunocompétent, l'évolution clinique est bénigne et spontanément résolutive. IgG et IgM de test doit être utilisée pour l'évaluation initiale des patients suspectés d'avoir la toxoplasmose. Essais de série d'échantillons à part 3 semaines en parallèle fournit l'évaluation la plus exacte si les résultats des tests initiaux sont équivoques. Dans les cas où la suspicion clinique est élevée, les échantillons doivent être sauvegardés pour répéter les essais au laboratoire de référence, en raison de la grande variation entre les laboratoires.
Dépistage de la toxoplasmose durant la grossesse:
Une étude multicentrique aux États-Unis a montré qu'environ 38% des femmes enceintes présentent des signes d'infection par la toxoplasmose avant (7). Preuve d'une infection antérieure signifie que la future mère n'est pas à risque de donner naissance à un enfant atteint de toxoplasmose congénitale. Sérologiques de dépistage comme moyen de prévenir la toxoplasmose congénitale auraient le plus d'impact dans les pays avec une fréquence élevée de la séropositivité et le dépistage prénatal de routine est réalisé en France et en Autriche. Toutefois, aux États-Unis, le dépistage de routine pendant la grossesse n'est actuellement pas recommandée, sauf chez les femmes infectées par le virus de l'immunodéficience humaine (VIH). Sérologiques de dépistage pendant la grossesse mai donnent des résultats équivoques, car les anticorps IgM peuvent persister pendant de longues périodes. Les circonstances exceptionnelles justifient le dépistage mai titer toxoplasmose pour les femmes enceintes qui sont propriétaires de chats. Une étude réalisée en Belgique a démontré une réduction de 63% du taux d'infection par la toxoplasmose maternelle après établissement d'un programme éducatif qui a recommandé d'éviter de manger de la viande insuffisamment cuite ou crue, de porter des gants lorsque vous travaillez avec le sol, et en évitant les soins pour les chats, sauf s'ils sont strictement «indoor cats «dont la nourriture est strictement contrôlée (8).
Périnatale évaluation et de suivi:
L'échographie peut démontrer la toxoplasmose congénitale grave; manifestations évocatrices comprennent ventriculomégalie, calcifications intracrâniennes, une microcéphalie, une ascite, une hépatosplénomégalie et une restriction de croissance intra-utérine. Des échantillons de sang foetal essais après 20 semaines de gestation pour la présence d'IgM spécifiques est le test le plus sensible dans le diagnostic de la toxoplasmose congénitale. Utilisation de sang ftal pour le test d'anticorps ou l'inoculation de la souris, le liquide amniotique pour la PCR, ou échographie ftale à détecter ventriculomégalie, 77-93% des nourrissons infectés peuvent être identifiés avant la naissance, même si aucun test unique est très sensible (8). Identification réussie de T gondii infection intra-utérine avec les tests de PCR du liquide amniotique permet de tester plus tôt que l'échantillonnage de sang ftal, avec une sensibilité élevée, bien que de faux positifs et de faux résultats négatifs ne se produisent.
Pour évaluer la sensibilité, spécificité et valeurs prédictives d'un liquide amniotique prénatal (AF) la réaction en chaîne par polymérase (PCR) pour le diagnostic de la toxoplasmose congénitale une étude prospective multicentrique a été réalisé sur 271 femmes ayant une infection avérée toxoplasmose primaire pendant la grossesse et qui avait pour l'amniocentèse diagnostic prénatal par PCR (12). Les enfants nés vivants étaient éligibles pour l'analyse que si un suivi sérologique pourrait évaluer un statut infectieux définitif.
Résultats: Sur les 270 cas évaluables, 75 ont été infectés congénitalement, 48 d'entre eux avaient une PCR positive au moment du diagnostic prénatal. La sensibilité globale de la PCR par le vol AF a été estimée à 64% (95% intervalle de confiance [IC] à 53,1%, 74,9%), la valeur prédictive négative de 87,8% (IC 95%: 83,5%, 92,1%), tandis que la spécificité et la valeur prédictive positive ont été 100% (95% IC 98%, 100% et 92,3%, 100%, respectivement). Parmi les cas de toxoplasmose congénitale, il n'y avait aucune différence significative entre ceux qui ont PCR positive ou négative à l'égard de l'âge gestationnel médian à l'infection maternelle, l'intervalle entre l'infection maternelle et l'amniocentèse ou la durée du traitement avant l'amniocentèse. Cependant, la sensibilité de la PCR a été jugée significativement plus élevé pour les infections chez la mère qui a eu lieu entre le 17 et de la gestation 21 e semaine (p <.02). Un test PCR négatif de la FA ne peut pas exclure une infection congénitale. Dans ce cas, la poursuite du traitement par spiramycine combiné avec l'échographie de suivi et de suivi post-natal sont justifiées. Les résultats suggèrent également le traitement présomptif associant pyriméthamine et sulfamides en cas d'infection maternelle survenant en fin de grossesse.
Chroniques ou récurrents maternelle Parasitémie:
Bien que la transmission congénitale de T gondii chez des animaux chroniquement infectés, il a longtemps pensé que l'infection maternelle primaire avec T gondii a dû se produire pendant la gestation, afin d'associer le conceptus. Ce concept n'est plus considéré comme valide. Dans une étude 34 gravidas ont été cultivées qui présentaient des signes sérologiques de la toxoplasmose chronique et dont la grossesse s'est terminée par un avortement, une mortinaissance, ou le décès néonatal. Les enquêteurs ont récupéré l'organisme dans les deux cas de l'avortement et dans un cas de décès néonatal (10). Gravidas n'avez pas à acquérir la primo-infection pendant la gestation de transmettre à l'organisme de conceptus. Parasitémie persistants dans la présente étude s'est produite en dépit des niveaux élevés d'anticorps antitoxoplasma. Toxoplasmose récurrent chez les personnes sévèrement immuno-compromis avec des CD 4 + T-cell les chiffres inférieurs à 50-100 cellules / mm 3 est un phénomène bien documenté. L'infection congénitale chez les descendants successifs mai se produire comme un événement très rare. Bien que le risque d'un enfant infecté seconde semble très faible, il existe néanmoins. Après la naissance d'un enfant congénitalement infectés, elle mai être prudent pour la mère d'utiliser une forme quelconque de contraception pendant au moins un an. La question de savoir ou de ne pas administrer des agents chimiothérapeutiques pour la mère est très controversée. Si le traitement est institué, c'est pour foetale potentielle et non pour des considérations maternelle.
Effet sur le ftus et du nouveau-né:
Le parasite Toxoplasma T mai traverser le placenta en association avec l'infection maternelle aiguë. L'organisme mai directement infecter le foetus et a été associée à une mort ftale sporadiques, qui se produisent en mai jusqu'à 5% des grossesses après l'infection du premier trimestre. Toutefois, le taux d'infection primaire est d'environ 1 pour 11.000 en les Etats-Unis (9). De nombreux cas de mort foetale ne subissent pas une évaluation adéquate des causes possibles. Autopsie périnatale et de l'examen du placenta sont peut-être les tests les plus précieux pour l'évaluation de la mort du foetus. Surveillance prénatale et le soutien affectif est le pilier de la gestion des grossesses ultérieures. L'importance relative de l'ensemble des infections est influencée par la prévalence locale des agents infectieux (13). La sévérité de l'infection dépend de l'âge gestationnel au moment de la transmission. Le plus tôt le foetus est infecté, le plus sévère de la maladie. La plupart des nourrissons infectés ne présentent pas de signes cliniques d'infection à la naissance, mais 55-85% vont développer des séquelles, y compris choriorétinite - conduisant à une insuffisance sévère de la vision. D'autres manifestations cliniques sont la perte d'audition ou d'un retard mental. Éruption cutanée, une hépatosplénomégalie, une ascite, de la fièvre, des calcifications périventriculaire, ventriculomégalie, et les saisies sont également observées dans les nouveau-nés et les nourrissons infectés par la toxoplasmose (9). LA TORCHE (sérologie pour la toxoplasmose, la rubéole, le cytomégalovirus et l'herpès simplex) baby due à gondii T est généralement infectés durant le premier trimestre de la grossesse. Deuxième trimestre de l'infection ftale, plus probablement, des résultats en formes frustes de la maladie, qui sont plus fréquents que les épanouie syndrome. Ces présentations cliniques sont inexpliquées hépatomégalie ou une hépatosplénomégalie, une coagulopathie intravasculaire disséminée présents à la naissance, ou une jaunisse dans les premières 24 heures de vie. Dans ces cas, le taux d'IgM sérique tend à être supérieure à 20 mg / mL; élévation du taux d'IgM est une jauge brute de la chronicité de l'infection.
La toxoplasmose congénitale:
L'infection congénitale peut se produire si une femme développe la toxoplasmose primaire aiguë pendant la grossesse. Chronique ou une infection latente est peu susceptible de causer des lésions ftales sauf peut-être chez un patient immunodéprimé. Environ 40% des nouveau-nés de mères ayant toxoplasmose aiguë montrent des signes d'infection. L'infection congénitale est le plus susceptible de se produire lorsque l'infection maternelle se développe dans le troisième trimestre. Moins de la moitié des nourrissons touchés sont symptomatiques à la naissance. Les manifestations cliniques de la toxoplasmose congénitale sont variées et sont résumés ci-dessous (7):
- Éruption cutanée;
- Hépatosplénomégalie;
- Ascite;
- Fièvre;
- Choriorétinite;
- Calcifications périventriculaire;
- Ventriculomégalie;
- Saisies;
- Le retard mental;
- Uvéite
Les tests les plus précieux pour le diagnostic anténatal de la toxoplasmose congénitale sont les ultrasons, cordocentèse, et l'amniocentèse. Conclusions Ultrasound évocateurs d'infection incluent ventriculomégalie, calcifications intracrâniennes, une microcéphalie, une ascite, une hépatosplénomégalie, et la restriction de croissance. Des échantillons de sang foetal peuvent être testés pour des anticorps IgM spécifiques après la gestation 20 à 22 semaines. Le sang ftal et le liquide amniotique peut être inoculé à des souris, et l'organisme peut être par la suite être récupérées à partir du sang d'animaux infectés. En outre, Hohlfeld et al, ont maintenant identifié un gène spécifique de T.gondii dans le liquide amniotique par PCR (6). Dans leur enquête, 34 de 339 nourrissons avaient toxoplasmose congénitale confirmé par des tests sérologiques ou d'autopsie. Tous les échantillons de liquide amniotique de grossesses touchées ont été positifs par PCR, et les résultats des tests étaient disponibles d'ici 1 jour de collecte des spécimens. Dans une enquête ultérieure, Romand et al (12) a signalé que le test PCR avaient une sensibilité de 64% (intervalle de confiance 95%, 53-75%) pour le diagnostic de la toxoplasmose congénitale. No-faux résultats positifs ont été notés, et la valeur prédictive positive était de 100%.
La gestion pendant la grossesse:
Toxoplasmose chez l'adulte immunocompétent est généralement asymptomatique ou une maladie auto-limités et ne nécessitent aucun traitement. Il est indiqué lorsque la toxoplasmose aiguë survient pendant la grossesse. Traitement de la mère réduit le risque d'infection congénitale et diminue les séquelles tardives de l'infection. Le traitement de la femme enceinte d'une toxoplasmose aiguë réduit mais n'élimine pas le risque d'infection congénitale (13). Identification de l'infection maternelle aiguë nécessite établissement immédiat d'un traitement avant que les résultats des tests du ftus sont connus. Spiramycine, qui se concentre dans le placenta, mai réduire le risque de transmission ftale de 60%, mais comme un agent unique, il ne traite pas établi l'infection ftale. Si l'infection ftale est établi; pyriméthamine, sulfadiazine, et leucovorine (acide folinique) sont ajoutés à la posologie de façon plus efficace, car ils éradiquer les parasites dans le placenta et le ftus que la spiramycine seule. Avec le traitement, même au début de l'infection ftale, la toxoplasmose peut entraîner des résultats de la grossesse réussie.
Spiramycine - 1,0 g, PO toutes les 8 heures.
Pyriméthamine - 50-100 mg, po deux fois par jour le 1er jour, puis 25 mg une fois par jour.
Sulfadiazine - 1-1,5 g, PO toutes les 6 horaire
Leucovorine (acide folinique) - 10 mg ou plus par jour.
Le traitement est administré pendant 1-2 semaines après résolution des signes / symptômes, continuer leucovorine (acide folinique) 1 semaine après l'arrêt de la pyriméthamine. Pour la toxoplasmose congénitale, Toxoplasma gondii la méningite chez l'adulte et choriorétinite ajouter prednisone 1 mg / kg / jour en 2 doses fractionnées, jusqu'à ce que tombe la concentration LCR ou de la vision en danger l'inflammation a disparu. Leucovorine (acide folinique), la dose est ajustée par la suite des résultats de Radio-Canada (14). Pyriméthamine n'est pas recommandé pendant le premier trimestre de la grossesse en raison d'effets tératogènes possibles même si cela n'a pas été rapporté à ce jour. Sulfamides peuvent être utilisés seuls, mais la monothérapie semble être moins efficace que la thérapie de combinaison. En Europe, la spiramycine a été largement utilisé pendant la grossesse avec un succès excellent. Il est disponible pour le traitement aux Etats-Unis par les Centers for Disease Control and Prevention (CDC).
Recommandations de l'Organisation mondiale de la Santé pour la toxoplasmose aiguë pendant la grossesse (10):
- Jusqu'à la fin de la 20 e semaine de gestation, neuf millions d'unités de spiramycine sont administrés par voie orale par jour pendant 4 semaines. Après 4 semaines, ce traitement est répété.
- Après 20 semaines de gestation, un cours de 4 semaines sulfadiazine (1,000 mg / jour) en association avec la pyriméthamine (25 mg / jour) et l'acide folinique (10 mg / semaine) sont administrés. Après une pause de 4 semaines, ce schéma se répète. Un maximum de trois cycles de traitement peuvent se produire entre 20 semaines de grossesse et l'accouchement.
Immuno-déprimés, toutefois, devrait être traitée, et le régime de choix est une combinaison de sulfadiazine par voie orale (4-g dose de charge, puis 1 g quatre fois par jour) et pyriméthamine (50 à 100 mg initialement, puis 25 mg par jour) . Chez le malade de ces longs cours de traitement mai être nécessaire pour guérir l'infection (14).
La chimiothérapie est indiqué chez les personnes qui ont des formes graves de toxoplasmose ou une déficience immunitaire du mécanisme de défense de l'hôte. Le traitement standard chez les adultes se compose de pyriméthamine (Daraprim) - 100 mg deux fois par jour pour le premier jour, suivie de 50 mg par jour par la suite, et la sulfadiazine - 1,5 g deux fois par jour. La combinaison de la pyriméthamine et sulfamides est synergique contre les trophozoïtes. La pyriméthamine - sulfadiazine - schéma thérapeutique de l'acide folinique est alternée toutes les trois semaines avec la spiramycine - 3 g par jour jusqu'à l'accouchement. Il n'existe aucun traitement efficace actuellement disponible contre la forme enkystée du T gondii. La thrombocytopénie, agranulocytose, ou une anémie mégaloblastique mai se développer comme une conséquence du traitement. La levure de boulanger 5-7 g par jour ou acide folinique 10-20 mg par jour doit être administré en même temps pour éviter la toxicité hématologique. Les femmes subissant un traitement doit être suivi de près avec les essais des leucocytes, des plaquettes, et de l'hématocrite déterminations bi-hebdomadaire. Pyriméthamine administration ne peut entraîner l'anémie mégaloblastique et / ou une pancytopénie.
Sulfadiazine peut entraîner une insuffisance rénale secondaire à la cristallisation dans les tubules rénaux et l'érythrodermie bulleuse avec épidermolyse sévère. Les personnes qui reçoivent ce médicament ont besoin de boire suffisamment et d'éviter la déshydratation. En raison des préoccupations, des éventuelles conséquences tératogènes, le médicament doit être évitée durant le premier trimestre en l'absence de considérations impérieuses maternelle.
Thérapie pour les indications ftales:
Il ya réserves à propos de commencer le traitement pour une gravida asymptomatiques présentant une infection aiguë pendant la gestation. Les indications de traitement sont celles de l'implication du foetus potentiel et non de dérivation maternelle. Seuls 25-35% des femmes dont la grossesse est compliquée par la toxoplasmose aiguë donnera naissance à un nouveau-né congénitalement infectés. En général, documenté d'infection maternelle est une indication pour la thérapie, indépendamment des signes et des symptômes de la maladie systémique. L'objectif thérapeutique vise à tenter d'éviter ou de limiter organismique future interaction cellulaire. Un consentement éclairé doit être obtenu qui indique clairement que le gravida est au courant non seulement des problèmes potentiels associés à la pharmacothérapie, mais aussi qu'elle ne bénéficiera pas en soi de la thérapie. Il devrait y avoir une volonté de la part de la mère à partager la responsabilité du traitement médicamenteux. Pour le traitement d'abord être retenu au cours de la période de l'organogenèse. Seulement un tiers des foetus sera effectivement besoin d'une thérapie, encore à 100% des foetus sera soumis à l'exposition au médicament pendant les périodes critiques de l'organogenèse. Les Européens préconisent l'utilisation de la spiramycine dès que le diagnostic de l'infection de la mère est établie. Une fois l'organogenèse est terminée, un régime de combinaison de traitements avec la pyriméthamine, sulfadiazine, et la spiramycine est mise en uvre, parce que la spiramycine ne traverse pas de façon fiable le placenta.
Sulfamides doit être interrompu deux à trois semaines avant la date présumée de l'accouchement pour éviter le problème de l'antagonisme compétitif avec la bilirubine dans la période post-partum. Les sulfamides avec succès la concurrence avec la bilirubine pour le site de liaison à l'albumine. Déplacements massifs de bilirubine à partir de sites liaison à l'albumine peut être responsable de l'induction de l'ictère nucléaire chez le nouveau-né. Des tests comparatifs ont montré que sulfapyrazine, sulfaméthazine et sulfamerazine sont à peu près aussi efficace que la sulfadiazine. Sulfathiazole, sulfapyridine, sulfadimetine, et sulfisoxazole sont beaucoup moins efficaces et ne sont pas recommandés. Le dosage habituel des sulfamides sulfadiazine ou triple est de 50-100 mg par kg de poids corporel toutes les 24 heures en deux à quatre doses égales par la bouche.
Le traitement précoce des nourrissons agressif avec la toxoplasmose congénitale est indiquée et se compose d'un traitement d'association (14). Traitement des nouveau-nés atteints de toxoplasmose congénitale symptomatique se compose de la pyriméthamine et la sulfadiazine, en alternance mensuelle avec la spiramycine, pendant 1 an. Le traitement va diminuer ou de résoudre des calcifications intracrâniennes s'il est présent, suggérant la fonction neurologique améliorée. Un traitement précoce réduit, mais n'élimine pas, la fin des séquelles de la toxoplasmose, comme choriorétinite.
Prévention:
Toxoplasma infection de la femme enceinte est évitable. Ceci est accompli par l'évitement de l'ingestion de kystes ou d'oocystes sporulés par la femme séronégative. Les kystes sont rendus non infectieux par chauffage à base de viande à 66 º C ou par le tabagisme ou la guérir. La congélation est moins fiable car elle nécessite de température (-20 º C) pas atteint par la plupart des congélateurs à la maison. Les fruits et légumes doivent être lavés et les mesures spécifiques prises pour empêcher l'accès aux mouches, les cafards et autres insectes à excréments d'animaux. Les mains doivent être lavées à fond après avoir manipulé la viande crue ou des légumes. Le traitement des excréments de chat doivent être évités. Si cela n'est pas possible, des gants jetables devraient être portés lors de l'élimination de la litière de chat et où le jardinage à l'extérieur. Le traitement de la litière pour chat casserole avec de l'eau bouillante soigneusement pendant cinq minutes sera tuer oocystes potentiellement infectieux. Dans une étude récente des facteurs de risque, fréquent contact avec le sol mai-être plus important de risque pour l'infection maternelle que la présence des ménages d'un chat. Les éléments clés dans la prévention de la toxoplasmose maternelle comprennent armement à base de viande jusqu'à ce qu'elle soit bien fait, le lavage des fruits et légumes et de porter des gants lorsque vous travaillez dans le jardin (si les chats fréquentent la zone) ou la sortie de la litière de chat (15). Il n'existe aucun médicament pour tuer les kystes de tissu T gondii dans les tissus humains ou animaux. La congélation à -20 º C, la cuisson à une température interne de 66 º C, ou l'irradiation gamma (0,5 kGy) peut tuer les kystes de tissu dans la viande.
Résumé:
Dépistage sérologique systématique de la toxoplasmose est probablement pas rentable, mais limitée examen préalable du gravidas qui aiment cru ou mal cuit la viande, qui ont des contacts significatifs avec des animaux ou qui ne le jardinage étendue est préconisée. Anticorps IgG spécifiques seront présents dans un nombre significatif de ces patients. Seuls ceux gravidas avec un titre spécifique concomitante d'IgM nécessité une nouvelle évaluation et de gestion. Tous gravidas qui sont un déficit immunitaire ou immunodéprimées devraient être examinés pour détecter la présence d'anticorps anti-toxoplasme. Les femmes séropositives doivent être étroitement surveillés pour la réactivation potentielle de la maladie. Une étude multicentrique aux États-Unis a constaté qu'environ 38% des femmes enceintes présentent des signes d'infection par la toxoplasmose avant. Preuve d'une infection antérieure signifie que la future mère n'est pas à risque de donner naissance à un enfant atteint de toxoplasmose congénitale. Aux États-Unis, le dépistage de routine pendant la grossesse n'est actuellement pas recommandée, sauf chez les femmes infectées par le virus de l'immunodéficience humaine (VIH). Les femmes enceintes qui contractent la toxoplasmose devrait être traitée avec la spiramycine. Lorsqu'elle est diagnostiquée, la toxoplasmose ftale doivent être traités avec une combinaison de la pyriméthamine, sulfadiazine, et l'acide folinique, en alternance avec la spiramycine. Le diagnostic de la toxoplasmose devrait être confirmé par un laboratoire de référence fiable.
Lectures suggérées:
- World Health Organization
Report of the WHO Working Group meeting on Toxoplasmosis Vaccine Development and Technology - US Department of Health and Human Services; National Toxicology Program
Toxoplasmosis - Center for Disease Control and Prevention
Toxoplasmosis and Pregnancy - Facts and Prevention
Références:
- Stray-Pedersen B. Toxoplasmosis in Pregnancy. Baillieres Clin Obstet Gynaecol 1993;7:107-137 (Level III)
- Levine EM. Risk factors for Toxoplasma gondii infection in mothers of infants with congenital toxoplasmosis: Implications for prenatal management and screening. Am J Obstet Gynecol 2006;194:589
- Egerman RS, Beazley D. Toxoplasmosis. Semin Perinatol 1998;22:332-338
- Lymph nodes. In Surgical Pathology; 9th edition. Editors: Rosai and Ackerman 2004. Publisher Mosby
- Hohlfeld P, Daffos F, Costa JM, et al. Prenatal diagnosis of congenital toxoplasmosis with a polymerase-chain-reaction test on amniotic fluid. N Engl J Med 1994;331:695-699 (Level II-2)
- Sever JL, Ellenberg H, Ley AC et al. Toxoplasmosis: maternal and pediatric findings in 23,000 pregnancies. Pediatrics 1988;82:181-192 (Level II-3)
- ACOG Practice Bulletin. Perinatal viral and parasitic infections. Number 20, September 2000
- Hill D, Dubey JP. Toxoplasmosis gondii: transmission, diagnosis and prevention. Clin Microbial Infect 2002;8:3-634-640
- Toxoplasma gondii. In Infectious diseases in obstetrics and gynecology; 5th edition. Editors: Monif GG, Baker DA; Parthenon publishing, 2004
- Bastien P. Molecular diagnosis of toxoplasmosis. Trans R Soc Trop Med Hyg 2002;96:S205-215
- Romand S, Wallon M, Franck J et al. Prenatal diagnosis using polymerase reaction on amniotic fluid for congenital toxoplasmosis. Obstet Gynecol 2001;97(2):296-300
- Goldenberg RL, Thompson C. The infectious origins of still birth. Am J Obstet Gynecol 2003;189:861-873
- Silver RM. Fetal Death. Obstet Gynecol 2007;109:153-167
- Duff P. Maternal and perinatal infections. In Obstetrics: Normal and Problem Pregnancies; 5th edition. Eds: Gabbe SG, Niebyl JR, Simpson JL. Publisher: Churchill Livingstone Elsevier; 2007
- Dean V, Coonrod BW, Jack PG et al. The clinical content of preconception care: infectious diseases in preconception care. Am J Obstet Gynecol 2008;199:S296-S309
Publié: 3 September 2009
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


