Токсоплазмоз: Перинатальный паразитарных инфекций
WHEC Практика бюллетень и клинической Управление Руководящие принципы для медицинских работников.Образовательного гранта, предоставляемых Здоровье женщин и центр образования (WHEC).
Много паразитические инфекции связаны со значительными матери и плода последствия, если приобретенные во время беременности. В общем, перинатальных инфекций плода более серьезные последствия, когда они случаются на ранних стадиях беременности, поскольку в первом триместре инфекции могут нарушить органогенеза. Второй и третий триместр инфекция может вызывать неврологические расстройства или нарушений роста. Toxoplasma gondii получила свое название от конкретного gondii, Северной Африки, грызунов, из которого этот protozoon был выделен в 1908 году. Распределение организма является повсеместным. Т gondii обладает способностью пройти линия видов и установить инфекции не только в домашних животных человеку, но в самом человеке. Toxoplasma существует в природе в трех формах: трофозоита, кисти и ооцисты. Наиболее важным способом передачи инфекции человеку во время приема плохо приготовленное мясо содержащие осумкованный организмов. Инфицирование человека происходит при заражении мяса заглатывании или когда пища кошки загрязненные фекалиями, через мух, тараканов, или пальцами. Темпы распространения инфекции являются самыми высокими в районах с плохими санитарными и стесненные жилищные условия. Stray Cats и домашних кошек, которые едят сырое мясо, скорее всего, нести паразита. Киста уничтожены под воздействием тепла. Подвержены кошки лишенный антитела к Т gondii будет заражаются после употребления продуктов, содержащих осумкованный организмы и будет выделять ооцист течение нескольких недель. Примерно 50% из семейства кошачьих впоследствии оспорено кисти кормления снова выделяют ооцист, что свидетельствует о вероятности того, что кот может быть инфекционным несколько раз в течение жизни. Те кошки, которые охотятся или едят сырым мясом путем заражения их от фекальной экскреции ооцист могут представлять собой потенциальную опасность для беременных.
Целью данного документа является описание способов передачи токсоплазмоза, матери и плода последствия, и предложить руководящие принципы для консультирования и управления ими во время беременности. Паразитарные инфекции связаны со значительными матери и плода последствия, если приобретенные во время беременности. Врожденный токсоплазмоз и профилактики, также обсуждаются в этом обзоре. Беременные женщины, которые приобретают токсоплазмоз следует лечить. Лечение беременных с острым токсоплазмозом снижается, но не устраняет риск врожденных инфекций.
Эпидемиология:
Токсоплазмоз вызывается внутриклеточным паразитом Toxoplasma gondii. Т gondii существует в нескольких формах: трофозоита, которая является инвазивной формой, и киста или ооцистой, которые являются скрытыми формами. Жизненный цикл T gondii зависит от диких и домашних кошек, которые являются единственными принимающей стороны ооцисты. Ооцистой образуется в кишечнике кошки, а затем выводятся с калом. Млекопитающих, таких как коровы, поглощают ооцистой, которая нарушается в кишечнике животных, освобождая инвазивные трофозоита. Трофозоита затем распространяются по всему организму, в конечном счете, формирование кист в головном мозге и мышцах. Инфицирование человека приобретается путем потребления кисти в недоваренных мясом инфицированных животных, насекомые загрязнения продуктов питания, при контакте с ооцист с фекалиями инфицированного кошек (только окончательное хосты), или при контакте с инфицированным материалом насекомых в почве (1) . Инфекция с Т gondii обычно протекает бессимптомно, хотя после инкубации 5-18 дней, некоторые неспецифических симптомов могут иметь место. Приблизительно от 40 до 50% взрослого населения в Соединенных Штатах имеют антитела к этому организм, и распространенность антител является самым высоким в низших социально-экономических групп населения. Частота сероконверсии во время беременности, составляет 5%, и примерно 3 в 11000 младенцев доказательства врожденной инфекции. Клинически врожденным токсоплазмозом значительные происходит приблизительно в 1 в 8000 беременностей. Токсоплазмоз чаще встречается в Западной Европе, в частности во Франции, скорее всего, из-за его практику в этой стране едят редких или сырого мяса. Более 80% женщин детородного возраста в Париже имеют антитела к Т gondii, заболеваемость врожденным токсоплазмозом примерно в два раза чаще, как в Соединенных Штатах Америки (2).
Примерно 20-25% женщин детородного возраста в выставке сша серологические признаки перенесенной инфекции gondii T. Хотя распространенность инфекции до увеличения с возрастом, ни разу это достижение высокой заболеваемости наблюдается за сопоставимый населения в некоторых тропических странах и во Франции. В Соединенных Штатах, 2-6 женщины за 1000 серологический подвержены женщины будут приобретать инфекции во время беременности. Примерно одна треть женщин, которые приобретают токсоплазмозом во время беременности передать инфекцию своему потомству. Позднее в беременности материнской инфекции приобретает, тем больше вероятность плода участие. Когда происходит заражение, первый триместр беременности, примерно 14% потомства будет инфицировано; показатели за инфекции, приобретенной во втором и третьем триместре на 29% и 59% соответственно. Ранее заражение происходит во время беременности, более серьезные заболевания у новорожденных. Почти во всех инфицированных детей, рожденных от матерей, которые приобретают инфекцию в третьем квартале появятся нормальные при рождении, и только спустя месяцы или годы разработке какого-либо клинические проявления инфекции.
Клинические проявления:
Проглотить вторгается в организм через кишечный эпителий и hematogenously распространяется по всему телу. Внутриклеточной репликации приводит к деструкции клеток. Клинические проявления инфекции являются результатом прямого повреждения органов и последующее иммунологический ответ на паразитемии и гибели клеток. Host иммунитета опосредовано в основном через Т-лимфоциты (3). Большинство случаев инфицирования людей являются показательными. Даже при отсутствии симптомов, однако, пациенты могут иметь свидетельство полиорганной участия и клиническими признаками заболевания могут следовать долгий период бессимптомных инфекций. Симптоматические токсоплазмоз обычно представляет как болезнь похожа на мононуклеоз. В отличие от инфекции в иммунокомпетентных хозяина, токсоплазмоз может быть разрушительным инфекции в ослабленным иммунитетом пациентов. Поскольку иммунитет к Т gondii является клеточный, пациенты с инфицирования человека вирусом иммунодефицита человека и тех, относиться с хроническими иммуносупрессивной терапии после трансплантации органов особенно восприимчивы к новым или вновь инфекции. У этих больных, дисфункция центральной нервной системы является наиболее распространенным проявлением инфекции. Выводы как правило, включают энцефалит, менингоэнцефалит и поражение внутримозговых массовой информации. Пневмонией, миокардитом и обобщенные лимфаденопатии также происходят часто.
Чаще всего токсоплазмоз представляет как бессимптомно шейки лимфаденопатии, с симптомами, происходящих в 10-20% взрослых. Другие симптомы включают повышение температуры, недомогание, ночная потливость, миалгии, и гепатоспленомегалия. Паразитемемия может произойти после заражения, которое у беременных женщин могут семени через плаценту и вызывать последующие плода инфекция. Врожденный передачи Т gondii зависит от времени приобретения материнской инфекции. Позднее в беременности, что заражение происходит, тем больше вероятность передачи должно произойти. Темпы увеличения вертикальной передачи вируса от 10% до 15% в первом триместре, до 25% во втором триместре беременности, и более чем 60% в третьем триместре беременности (2). В акушерско населения, наиболее широко признано проявлением острого токсоплазмоза является лимфаденопатия. Это может быть единственным представления знака или могут быть связаны фебрильной реакции. Узловой расширение может включать focally шейки матки, надключичные или паховых областей, и часто односторонние. Узловой биопсии, в связи с отсутствием значительных лимфаденит, за счет фирмы, не тендер, увеличенные лимфатические узлы обычно наблюдается. С более развитыми болезней, усталости является самым распространенным симптомом более серьезных инфекций. Это может быть связано с головной болью, депрессия, миалгии, и низкосортных периодические лихорадки. Мигрирующие полиартриты и различных видов преимущественно макулярной сыпь также были описаны. В редких случаях, боль в животе вторичными по отношению к брыжеечных лимфатический узел может быть основным представления жалобы. Суровые проявления системных заболеваний миокардит, менингоэнцефалит, или обоих.
Диагноз:
Диагноз токсоплазмоза у матери может быть подтвержден серологических и гистологических методов. Т gondii легче всего определить в мозге и лимфатических тканей. Гистологические препараты могут быть рассмотрены световой и электронной микроскопии. Для световой микроскопии, образцы должны быть окрашены либо Гимза или пятна Райта (4). Основной характерной гистологической этих лимфатических узлов отмечается гиперплазия ретикулярных клеток. Микроскопически узловых архитектура довольно хорошо сохранился. Типичный триада болезней, которые, однако, не во всех случаях, состоит из (а) отмечены фолликулярная гиперплазия, связанных с интенсивным митотической активности и фагоцитоза ядерный мусор (б) малые гранул почти полностью состоит из клеток эпителиоидным , расположенных в пределах гиперплазией фолликулов и периферией, посягающих на размытость и свою маржу, и (с) вздутия маргинальных и корковые синусы по monocytoid клетки. Дополнительной функцией является наличие immunoblasts и плазменных клеток в мозговой шнуры (5). Вариации на тему включают присутствие в гранулу некроза или более чем иногда Лангганс 'гигантских клеток.
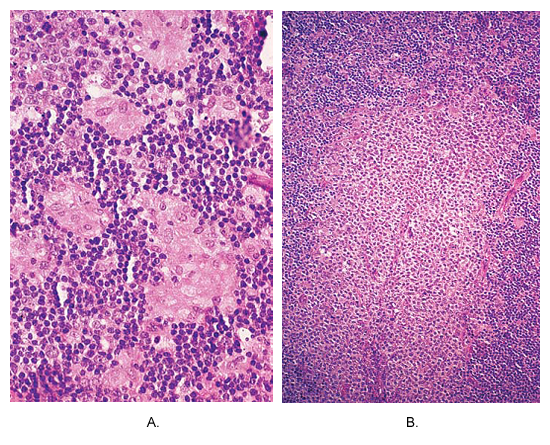
Токсоплазмоз лимфатических узлов. (А), отличное от caseating гранул в составе эпителиоидным клетки находятся на периферии гиперпластических фолликула. Эта фотография почти патогномоничной этого заболевания. (B) области массовых monocytoid B-клеточная гиперплазия.
Изоляция Т gondii с кровью и другими жидкостями устанавливает, что инфекция является острой, однако серологических тестов для выявления специфических антител к Т gondii является основным методом диагностики. После острой инфекции, IgM антитела появляются рано и достичь максимального уровня в 1 месяц. IgG антитела появляются после антител IgM, можно обнаружить в течение нескольких недель после инфицирования, и иммунитет. Высокие титры как IgM и IgG могут сохраняться в течение многих лет. В иммунокомпетентных взрослых, клинического течения доброкачественных и самоограничения. IgG и IgM испытаний должны быть использованы для первоначальной оценки пациентами с подозреваемой токсоплазмоз. Испытания серийного образца 3 недель друг от друга в параллельных дает наиболее точную оценку, если первоначальные результаты испытаний, неоднозначны. В случаях, когда клинические подозрения высок, образцы должны быть сохранены для повторного тестирования в референс-лаборатория, из-за широкой вариации между лабораториями.
Скрининг на токсоплазмоз во время беременности:
Многоцентрового исследования в США показали, что примерно 38% беременных женщин имеют доказательства предварительного инфицирования токсоплазмозом (7). Доказательством предыдущей инфекции означает, что будущая мать не рискуют родить ребенка с врожденным токсоплазмозом. Серологического скрининга в качестве способа предотвращения врожденного токсоплазмоза будет иметь наибольшее влияние в странах с высокой частотой серопозитивности, и обычные пренатального скрининга проводится во Франции и Австрии. Однако в Соединенных Штатах, регулярное обследование во время беременности в настоящее время не рекомендуется, за исключением женщин, инфицированных вирусом иммунодефицита человека (ВИЧ). Серологического скрининга во время беременности может принести сомнительных результатов, так как IgM антитела могут сохраняться в течение длительного периода времени. Исключительные обстоятельства не могут оправдать скрининг токсоплазмоза титр для беременных женщин, которые являются владельцами кошки. Одно из исследований в Бельгии, показал 63% снижение уровня материнской инфекции токсоплазмоз после учреждения образовательные программы, которые рекомендовали избегать едят сырой или плохо приготовленное мясо, перчатки при работе с землей, и во избежание ухода за кошками, если они не строго "крытый кошек "Чья пища жестко контролируется (8).
Перинатальная Оценка и мониторинг:
УЗИ может продемонстрировать серьезный врожденным токсоплазмозом; наводящий выводы включают вентрикуломегалия внутричерепной кальцификации, микроцефалия, асцит, гепатоспленомегалия и ограничения внутриматочного роста. Тестирование образцов крови плода после 20 недель беременности на наличие специфических IgM является наиболее чувствительных тест в диагностике врожденного токсоплазмоза. Использование крови плода для тестирования антител или мыши прививки, амниотической жидкости для ПЦР, или плода УЗИ для выявления вентрикуломегалия 77-93% инфицированных младенцев могут быть определены пренатальной, хотя ни одного теста очень чувствительны (8). Успешная идентификация Т gondii внутриутробная инфекция с ПЦР-тестирование амниотической жидкости позволяет раньше, чем тестирование плода забор крови, с высокой чувствительностью, хотя и ложно-положительных и ложно-отрицательные результаты имеют место.
Для оценки чувствительности, специфичности и интеллектуального значение пренатального амниотической жидкости (AF) полимеразной цепной реакции (ПЦР) тесты для диагностики врожденного токсоплазмоза многоцентровое проспективное исследование было сделано на 271 женщин с доказанным первичного инфицирования токсоплазмозом во время беременности и амниоцентез, который для пренатальная диагностика методом полимеразной цепной реакции (12). Живорожденных младенцев, имеют право на анализ только тогда, когда серологические последующие могли оценить окончательный статус инфекции.
Результаты: Из 270 случаев анализу, 75 были врожденно инфицированных, 48 из которых имели положительный ПЦР в пренатальной диагностике. Общую чувствительность ПЦР на Ф. оценивается в 64% (95% доверительный интервал [ДИ] 53,1%, 74,9%), отрицательная прогностическая ценность 87,8% (95% ДИ 83,5%, 92,1%), тогда как специфичность и положительная прогностическая ценность были 100% (95% ДИ 98%, 100% и 92,3%, 100%, соответственно). Среди больных с врожденным токсоплазмозом, не было никаких существенных различий между теми, с положительной или отрицательной ПЦР в отношении медианы гестационного возраста материнской инфекции, интервал между материнской инфекции и амниоцентез, или продолжительности лечения до амниоцентез. Однако был найден чувствительность ПЦР быть значительно выше для материнской инфекции, которые имели место в период 17 и 21 неделями беременности (p <.02). Отрицательная ПЦР АФ не может исключать врожденной инфекции. В данном случае, оправдано продолжение лечения в сочетании с спирамицин ультразвукового контроля и послеродовой последующей деятельности. Результаты также свидетельствуют обращения предполагаемого объединения пириметамин и сульфаниламиды в случае материнской инфекции происходит на поздних сроках беременности.
Хронические или периодические Материнская Паразитемемия:
Хотя врожденной инфекции Т gondii происходит в хронически инфицированных животных, она уже давно полагали, что первичной материнской инфекции с Т gondii было произойти во время беременности с целью привлечения зародыш. Эта концепция уже не считаться действительными. В исследовании 34 gravidas культивировали который показал серологические признаки хронического токсоплазмоза и беременность которой прекращено в аборты, мертворождения, или неонатальной смерти. Следователи вернули организме в двух случаях абортов, а в одном случае неонатальной смертности (10). Gravidas не нужно приобретать первичной инфекции во время беременности, чтобы передать организм зародыша. Стойкие паразитемия в этом исследовании, произошло несмотря на высокие уровни антител противотоксоплазменных. Периодические токсоплазмоза у тяжело с нарушением иммунной системы людей с CD 4 + Т-клеток менее 50-100 клеток / мм 3 хорошо документированы явлением. Врожденная инфекция в последующие потомки могут возникнуть в очень редких случаях. Хотя риск второго инфицированного младенец очень мала, тем не менее он существует. После рождения от рождения инфицированного ребенка, он может быть разумным для матери использовать некоторые формы контрацепции в течение не менее одного года. Вопрос о том, следует ли управлять химиотерапевтических агентов к матери является весьма противоречивым. Если возбуждено терапию, то для потенциального плода, а не для материнской соображений.
Влияние на плод и новорожденного:
Паразит gondii Т может проникать через плаценту в связи с острой материнской инфекции. Организм может напрямую инфицировать плод и был связан с спорадический гибель плода, которые могут возникнуть в до 5% беременностей после первого триместра беременности инфекции. Тем не менее, уровень первичной инфекции составляет около 1 на 11000 в Соединенных Штатах (9). Многие случаи смерти плода не проходят для адекватной оценки возможных причин. Перинатальные вскрытия и рассмотрения плаценты являются, пожалуй, самое ценное тестов для оценки гибели плода. Дородовое наблюдение и эмоциональной поддержки является основой последующего управления беременности. Относительная важность всех инфекций зависит от местной распространенности инфекционных агентов (13). Тяжести инфекции зависит от гестационного возраста на момент передачи. Ранее плод инфицирован, тем более тяжелыми заболеваниями. Большинство инфицированных детей не имеют клинических признаков инфекции при рождении, но 55-85% будет развиваться осложнения, в том числе хориоретинит - ведет к серьезному ухудшению зрения. Другие клинические проявления потерю слуха или умственной отсталости. Сыпь, гепатоспленомегалия, асцит, лихорадка, перивентрикулярного кальцинозов, вентрикуломегалия и изъятий также видели у новорожденных и грудных детей инфицированы токсоплазмозом (9). TORCH (серология на токсоплазмоз, краснуха, цитомегаловирус и вирус простого герпеса) ребенка в связи с Т gondii, как правило, инфицированных в течение первого триместра беременности. Второй триместр плода инфекции более вероятно, приводит к Formes frustes болезней, которые являются более общими, чем полномасштабная синдром. Эти клинические проявления необъяснимые гепатомегалия или гепатоспленомегалия, ДВС-настоящему коагулопатии при рождении, или желтуха в первые 24 часов жизни. В этих случаях, уровня сывороточных IgM, как правило, больше, чем 20 мг / мл, высота уровня IgM является грубым датчика хронической инфекции.
Врожденный токсоплазмоз:
Врожденная инфекция может возникнуть, если женщины развивается острый первичного токсоплазмоза во время беременности. Хронические или латентной инфекции, вряд ли вызовет повреждение плода, за исключением, возможно, в ослабленным иммунитетом пациентов. Около 40% новорожденных, рожденных от матерей с острым токсоплазмозом доказательства инфекции. Врожденная инфекция чаще всего возникает, когда материнская инфекция развивается в третьем триместре беременности. Менее половины пострадавшие дети являются симптомами при рождении. Клинических проявлений врожденного токсоплазмоза разнообразны и приводится ниже (7):
- Сыпь;
- Гепатоспленомегалия;
- Асцит;
- Лихорадка;
- Хориоретинит;
- Перивентрикулярного кальцификация;
- Вентрикуломегалия;
- Судороги;
- Задержкой психического развития;
- Увеит
Наиболее ценные тесты для дородовой диагностики врожденного токсоплазмоза являются УЗИ, cordocentesis и амниоцентез. Ультразвуковой выводов наводящий инфекции включают вентрикуломегалия внутричерепной кальцификации, микроцефалия, асцит, гепатоспленомегалия, и рост ограничений. Плод образцы крови могут быть проверены на IgM-специфических антител после беременности от 20 до 22 недель. Крови плода и амниотической жидкости может быть привитой мышам, и организм может впоследствии быть взысканы с кровью инфицированных животных. Кроме того, Hohlfeld и др., уже определен конкретный ген Т.gondii в амниотической жидкости с помощью ПЦР (6). В своем исследовании, 34 из 339 младенцев врожденным токсоплазмозом была подтверждена серологических тестов или вскрытия. Все образцы околоплодных вод из зараженных беременностей были положительными методом ПЦР, и результаты испытаний были доступны в течение 1 дня сбора образцов. В последующем расследовании, Romand и др. (12) сообщили, что тест ПЦР была общая чувствительность 64% (95% доверительный интервал 53-75%) для диагностики врожденного токсоплазмоза. Были отмечены не ложно-положительных результатов, а также положительная прогностическая ценность составила 100%.
Управление во время беременности:
Токсоплазмоза у иммунокомпетентных взрослые, как правило, бессимптомно или самоограничивающийся болезни и не требует лечения. Она указала, когда возникает острая токсоплазмозом во время беременности. Обращение с матерью снижает риск врожденной инфекции и уменьшается отдаленных последствий инфекции. Лечение беременной женщины с острым токсоплазмозом снижается, но не устраняет риск врожденных инфекций (13). Определение острой материнской инфекции требует немедленного лечения учреждения пока результатов тестирование плода известны. Спирамицин, который концентрируется в плаценте, может снизить риск передачи плода на 60%, но в качестве монотерапии, он не создан лечению инфекций плода. Если будет установлен плода инфекция; пириметамин сульфадиазином и лейковорин (фолиевой кислоты) добавила к режиму, потому что они более эффективного искоренения паразитов в плаценте и в плоде спирамицин, чем в одиночку. С лечением, даже в начале плода инфекция токсоплазмоза может привести к успешным результатам беременности.
Спирамицин - 1,0 г, по каждые 8 часов.
Пириметамин - 50-100 мг, по два раза в день на 1 день, затем 25 мг один раз в день.
Сульфадиазина - 1-1,5 г, каждая по 6 часов
Лейковорин (фолиевой кислоты) - 10 мг или более в день.
Рассмотрение проводится в течение 1-2 недель после разрешения Знаки / симптомы; продолжать лейковорин (фолиевой кислоты) 1 неделю после прекращения пириметамина. Для врожденным токсоплазмозом, ТОХО менингита у взрослых и хориоретинит добавить преднизон 1 мг / кг / сутки в 2 приема, до РСУ концентрация падает зрение или угрожающие воспаление начнет затухать. Лейковорин (фолиевой кислоты) доза регулируется следующими результатами CBC (14). Пириметамин не рекомендуется для использования в течение первого триместра беременности из-за возможного тератогенного хотя это не было зарегистрировано на сегодняшний день. Сульфонамиды может быть использован самостоятельно, но одно-агент терапия оказывается менее эффективной, чем комбинированная терапия. В Европе, спирамицин широко применялся во время беременности с отличным успехом. Она доступна на лечение в Соединенные Штаты через Центры по контролю и профилактике заболеваний (CDC).
Рекомендации Всемирной организации здравоохранения по острым токсоплазмозом во время беременности (10):
- Вплоть до конца 20-й недели беременности, девять миллионов единиц спирамицин являются пероральный ежедневно в течение 4 недель. После 4 недель повторили этот режим.
- После 20 недель беременности, 4 недельный курс сульфадиазина (1000 мг / сутки) в сочетании с пириметамина (25 мг / сут) и фолиевой кислотой (10 мг / неделю) находятся в ведении. После паузы 4 недель повторили этот режим. Максимальная из трех циклов лечения может произойти в период с 20 недель беременности и родов.
Ослабленным иммунитетом пациентов, однако, должно рассматриваться, и режим выбора сочетания устных сульфадиазина (4-G ударная доза, затем 1 г четыре раза в день) плюс пириметамина (от 50 до 100 мг первоначально, затем 25 мг в день) . В таких пациентов, расширенные курсы лечения могут быть необходимы для лечения инфекций (14).
Химиотерапия указаны для лиц, которые имеют тяжелые формы токсоплазмоза или иммунологические нарушения защитного механизма хозяина. Стандартное лечение у взрослых состоит из пириметамина (Daraprim) - 100 мг два раза в день в течение первых дней, затем 50 мг в день в последующий период, и сульфадиазина - 1,5 г два раза в день. Сочетание пириметамин и сульфаниламиды является синергетический против трофозоитами. Пириметамину - сульфадиазина - режим фолиевой кислоты чередовались каждые три недели с спирамицин - 3 г в день вплоть до родов. Существует нет эффективной терапии в настоящее время в отношении осумкованный форма Т gondii. Тромбоцитопения, агранулоцитоз, или мегалобластной анемия может развиться в результате лечения. Пекарские дрожжи 5-7 г в день или фолиевой кислотой 10-20 мг ежедневного следует, чтобы избежать одновременного гематологической токсичности. Женщины, проходящие лечение, следует внимательно следил с анализов лейкоцитов, тромбоцитов и гематокрита би-определений в неделю. Пириметамин администрация может привести к мегалобластной анемия и / или панцитопения.
Сульфадиазина может вызывать почечную недостаточность средней к кристаллизации в течение почечных канальцев и серьезные эпидермальный некролиз. Лиц, получающих этот препарат нужно пить достаточное жидкостей и избежать обезвоживания. Из-за обеспокоенности последствиями возможного тератогенного, препарат следует избегать в первом триместре беременности в отсутствие главного материнской соображений.
Терапия для плода Показания:
Существует оговорка о возбуждении терапии бессимптомных Gravida с острой инфекции во время беременности. Показаниями для лечения являются те потенциального плода участие, а не материнского вывода. Лишь 25-35% женщин, у которых беременность осложняется острым токсоплазмозом родит от рождения инфицированного новорожденного. В общем, документально материнской инфекции является показанием для терапии, независимо от признаков и симптомов системного заболевания. Терапевтический фокус направлен на попытки предотвратить или ограничить будущее организменном-клеточного взаимодействия. Информированное согласие должно быть получено в которой четко указывается, что Gravida известно не только о потенциальных проблемах, связанных с лекарственной терапии, но также, что она ничего не выиграет от таковой терапии. Там должна быть готовность со стороны матери, чтобы разделять ответственность за медикаментозной терапии. Для первого терапии быть отказано в период органогенеза. Лишь одна треть из плодов действительно требует лечения, но 100% плодов будут подвергаться воздействию наркотиков в критические периоды органогенеза. Европейцы выступают за использование спирамицин, как только диагностика материнской инфекции устанавливается. После завершения органогенеза, реализован режим лечения с использованием сочетания пириметамин сульфадиазина и спирамицин, спирамицин, поскольку он не всегда достоверно через плаценту.
Сульфонамиды должны быть прекращены две-три недели до предполагаемой даты родов, чтобы предотвратить проблемы конкурентного антагонизма с билирубина в послеродовом периоде. Сульфаниламиды успешно конкурировать с билирубина для связывания альбумина. Масштабное перемещение билирубина с сайтами связывания альбумина может быть ответственным за индукцию ядерная желтуха у новорожденных. Сравнительные испытания показали, что sulfapyrazine, sulfamethazine и sulfamerazine собираетесь же эффективным, как сульфадиазина. Sulfathiazole, sulfapyridine, sulfadimetine и sulfisoxazole гораздо менее эффективны и не рекомендуются. Обычная доза сульфадиазина или тройной сульфаниламиды составляет 50-100 мг / кг веса тела каждые 24 часа в два-четыре равные дозы при помощи рта.
Агрессивный раннее лечение детей с врожденным токсоплазмозом указано и состоит из комбинированной терапии (14). Лечение детей с врожденным токсоплазмозом симптоматическое состоит пириметамина и сульфадиазина, чередующиеся с спирамицин ежемесячно, в течение 1 года. Лечение будет уменьшаться или устранения внутричерепной кальцификации если он присутствует, предложив улучшению неврологических функций. В начале лечения снижается, но не устраняет, отдаленных последствий таких, как токсоплазмоз хориоретинит.
Профилактика:
Toxoplasma инфекцией беременной женщины может быть предотвращена. Это достигается путем избежания употребления кисти или sporulated ооцист по серонегативных женщина. Киста оказываются неинфекционного нагревание мяса на 66 ° С или от курения или лечить его. Замораживание является менее надежным, поскольку он требует температуре (-20 º С) не достигается наиболее морозильники домой. Сырые фрукты и овощи необходимо тщательно мыть и конкретные шаги, предпринятые для предотвращения доступа к мух, тараканов и других насекомых фекалиями животных. Руки необходимо мыть руки после работы с сырым мясом или овощами. Обращение с кошкой кала следует избегать вообще. Если это не представляется возможным, одноразовые перчатки следует надевать во время утилизации кошачьих туалетов и когда садоводство из дверей. Лечение кошачьих туалетов сковороду с аккуратно кипящей воде в течение пяти минут будут убивать потенциально инфекционного ооцист. В ходе недавнего исследования факторов риска, частый контакт с почвой может быть более важным риском материнской инфекции, чем бытовые присутствии кота. Ключевыми элементами для предотвращения материнской токсоплазмоза включают взвода мяса, пока он хорошо сделал, мойки овощей и фруктов и перчатки при работе в саду (если кошки частые области) или утилизации кошачьих туалетов (15). Есть нет средств, чтобы убить Т gondii кист в тканях человека и животных тканях. Замерзания до -20 º C, приготовление к внутренней температуре 66 º C, или гамма-облучения (0,5 кГр) может убить тканей кисти в мясе.
Резюме:
Регулярное серологическое обследование на токсоплазмоз, вероятно, не является экономически эффективным, однако ограниченные проверки gravidas кто любит сырое или плохо приготовленное мясо, которые имеют значительный контакт с животными или кто выступал делать обширную садоводством. IgG специфических антител будет присутствовать в значительное число этих пациентов. Только те, gravidas с сопутствующими конкретные титр IgM нуждаются в дальнейшей оценке и управлению. Все gravidas которых иммунологическая скомпрометирован или ослабленным иммунитетом, должна проверяться на наличие анти-Toxoplasma антител. Серопозитивным женщинам необходимо тщательно контролироваться на предмет потенциального возобновления болезни. Многоцентрового исследования в США показали, что примерно 38% беременных женщин имеют доказательства предварительного инфекция токсоплазмоза. Доказательством предыдущей инфекции означает, что будущая мать не рискуют родить ребенка с врожденным токсоплазмозом. В Соединенных Штатах, рутинный скрининг во время беременности в настоящее время не рекомендуется, за исключением женщин, инфицированных вирусом иммунодефицита человека (ВИЧ). Беременные женщины, которые приобретают токсоплазмоз следует относиться с спирамицином. Когда диагноз плода токсоплазмозом следует относиться с сочетанием пириметамин сульфадиазина и фолиевой кислотой, чередующиеся с спирамицином. Диагноз токсоплазмоза должны быть подтверждены надежными референс-лаборатория.
Рекомендуемая литература:
- World Health Organization
Report of the WHO Working Group meeting on Toxoplasmosis Vaccine Development and Technology - US Department of Health and Human Services; National Toxicology Program
Toxoplasmosis - Center for Disease Control and Prevention
Toxoplasmosis and Pregnancy - Facts and Prevention
Список литературы:
- Stray-Pedersen B. Toxoplasmosis in Pregnancy. Baillieres Clin Obstet Gynaecol 1993;7:107-137 (Level III)
- Levine EM. Risk factors for Toxoplasma gondii infection in mothers of infants with congenital toxoplasmosis: Implications for prenatal management and screening. Am J Obstet Gynecol 2006;194:589
- Egerman RS, Beazley D. Toxoplasmosis. Semin Perinatol 1998;22:332-338
- Lymph nodes. In Surgical Pathology; 9th edition. Editors: Rosai and Ackerman 2004. Publisher Mosby
- Hohlfeld P, Daffos F, Costa JM, et al. Prenatal diagnosis of congenital toxoplasmosis with a polymerase-chain-reaction test on amniotic fluid. N Engl J Med 1994;331:695-699 (Level II-2)
- Sever JL, Ellenberg H, Ley AC et al. Toxoplasmosis: maternal and pediatric findings in 23,000 pregnancies. Pediatrics 1988;82:181-192 (Level II-3)
- ACOG Practice Bulletin. Perinatal viral and parasitic infections. Number 20, September 2000
- Hill D, Dubey JP. Toxoplasmosis gondii: transmission, diagnosis and prevention. Clin Microbial Infect 2002;8:3-634-640
- Toxoplasma gondii. In Infectious diseases in obstetrics and gynecology; 5th edition. Editors: Monif GG, Baker DA; Parthenon publishing, 2004
- Bastien P. Molecular diagnosis of toxoplasmosis. Trans R Soc Trop Med Hyg 2002;96:S205-215
- Romand S, Wallon M, Franck J et al. Prenatal diagnosis using polymerase reaction on amniotic fluid for congenital toxoplasmosis. Obstet Gynecol 2001;97(2):296-300
- Goldenberg RL, Thompson C. The infectious origins of still birth. Am J Obstet Gynecol 2003;189:861-873
- Silver RM. Fetal Death. Obstet Gynecol 2007;109:153-167
- Duff P. Maternal and perinatal infections. In Obstetrics: Normal and Problem Pregnancies; 5th edition. Eds: Gabbe SG, Niebyl JR, Simpson JL. Publisher: Churchill Livingstone Elsevier; 2007
- Dean V, Coonrod BW, Jack PG et al. The clinical content of preconception care: infectious diseases in preconception care. Am J Obstet Gynecol 2008;199:S296-S309
Опубликован: 3 September 2009
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


