Síndrome del ovario poliquísticoEl síndrome de ovario poliquístico (SOP) es una enfermedad inexplicable estado de anovulación crónica. En 1935, Stein y Leventhal describieron por primera vez un complejo de síntomas relacionados con la anovulación. La aceptación de este síndrome como una entidad clínica singular dado lugar a un enfoque más rígido a este problema durante muchos años. Sólo las mujeres calificadas que tenían una historia de oligomenorrea, hirsutismo y la obesidad, junto con una demostración de morfología ovárica poliquística. Es mucho más útil en la clínica para evitar el uso de epónimos y hasta el término síndrome de ovario poliquístico o la enfermedad. Es mejor considerar este problema como uno de anovulación persistente con un espectro de etiologías y manifestaciones clínicas. Hallazgos recientes sugieren el síndrome de ovario poliquístico (SOP) tiene secuelas metabólicas importantes, incluyendo el riesgo de diabetes y, posiblemente, de las enfermedades cardiovasculares, y que el tratamiento primario debe centrarse en las secuelas metabólicas. Su etiología sigue siendo desconocida, y el tratamiento es en gran parte basado en los síntomas y empírica. El propósito de este documento es mejorar la comprensión de la mejor evidencia disponible sobre el diagnóstico y manejo clínico de síndrome de ovario poliquístico (SOP). Una cuestión que ha intrigado a los ginecólogos y endocrinólogos durante muchos años es la causa de ovarios poliquísticos. El ovario poliquístico característica surge cuando un estado de anovulación persiste por un período de tiempo. Si el diagnóstico es por ecografía o por los criterios clínicos y bioquímicos tradicionales, una muestra representativa de mujeres con anovulación y en cualquier punto del tiempo revelan que aproximadamente el 75% tienen ovarios poliquísticos. Gran variedad de tratamientos de SOP se analiza también en este capítulo y los proveedores de salud deben apreciar el impacto clínico de la anovulación y se deben hacer las gestiones adecuadas. Etiología:N gen o sustancia ambiental específico ha sido identificado como causa el SOP. Resistencia a la insulina selectiva puede ser central en la etiología del síndrome: el músculo esquelético es profundamente resistentes y otros tejidos (hipotálamo, suprarrenales y ovario) siguen siendo sensibles a los efectos de la insulina. Del ovario poliquístico, es considerado como un resultado de un trastorno funcional, no un defecto central o local específica. En contraste con la imagen característica de la fluctuación de los niveles de hormonas en el ciclo normal, un "estado estable" de gonadotropinas y los esteroides sexuales pueden ser representados en asociación con anovulación persistente. Este estado estacionario es sólo relativa, y se está exagerando aquí para presentar un concepto de este problema clínico. Compensatorios aumento en los niveles de insulina puede dar lugar a niveles reducidos de globulina hormona sexual (SHBG) y servir de estímulo trófico para la producción de andrógenos en la glándula suprarrenal y el ovario (1). La obesidad puede estar asociada con tres alteraciones que interfieren con la ovulación normal, y la pérdida de peso mejora los tres: aumento de la aromatización periférica de andrógenos a estrógenos, los niveles de disminución de la globulina de hormonas sexuales (SHBG), resultando en mayores niveles de estradiol libre y la testosterona, la insulina nivel que puede estimular la producción de tejido estromal ovárica de andrógenos. Definition and Diagnostic Criteria:Aunque no existe una definición universalmente aceptada del SOP, los criterios diagnósticos establecidos por el Instituto Nacional de Salud en 1990 lo definen como hiperandrogenismo y anovulación crónica en los casos en que las causas secundarias (como adulta hiperplasia suprarrenal congénita, la hiperprolactinemia, y secreción de andrógenos neoplasias) han sido excluidos. Resistencia a la insulina se ha observado consistentemente entre muchas mujeres con anovulación crónica inexplicada hiperandrogenismo, pero no está incluido en los criterios diagnósticos. Ecografía de las mujeres con anovulación crónica inexplicada hiperandrogenismo frecuentemente muestran ovarios poliquísticos que aparecen, sin embargo, los ovarios poliquísticos son un hallazgo inespecífico, y también se observa con frecuencia en mujeres sin alteraciones endocrinas o metabólicas. Anovulación, hiperandrogenismo crónica ocurre en aproximadamente un 4-6% de las mujeres, sin diferencias significativas en la prevalencia de hirsutismo o aumento de los niveles circulantes de andrógenos entre las mujeres en blanco y negro (2). La prevalencia del SOP en mujeres en edad reproductiva es de aproximadamente 5%, lo que es uno de los trastornos de la reproducción más comunes. Entre las mujeres con disfunción ovulatoria, aproximadamente el 70% tiene SOP. En el mayor ensayo clínico realizado hasta la fecha de las mujeres del SOP, el 50-60% de las 400 mujeres prospectivamente identificados como anovulación crónica hiperandrogenismo, no tenía pruebas de hirsutismo. Sin embargo, no todas las mujeres con hirsutismo tendrán exceso de andrógenos, y no todas las mujeres con exceso de andrógenos se han hirsutismo. Hiperandrogenismo puede establecerse sobre la base de los hallazgos clínicos (por ejemplo, hirsutismo o acné) o la medición de la hormona o ambos. El ovario poliquístico es generalmente aumentan de tamaño y se caracteriza por una cápsula lisa de color blanco nacarado. Las características de ovario reflejan esta disfunción es: la superficie se duplica, dando un aumento de volumen medio de 2,8 veces, el mismo número de folículos primordiales está presente, pero el número de folículos en crecimiento y atrésico (hasta la fase de folículo secundario) duplicado. Cada ovario puede contener 20-100 folículos quística. El espesor de la túnica (capa exterior) se incrementa en un 50%. Un incremento de un tercio del grosor del estroma cortical y un aumento de 5 veces en un estroma subcortical se observan. El estroma aumento se debe tanto a la hiperplasia de células de la teca y de una mayor formación posterior a la maduración folicular y la atresia excesivo. Hay 4 veces más hilio ovárico nidos de células (hiperplasia). 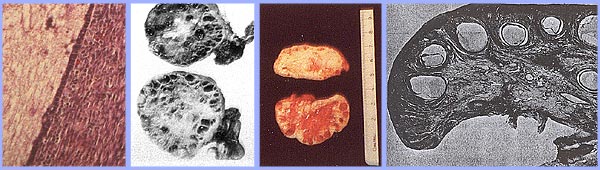 Del ovario poliquístico, con una cápsula gruesa y prominente quistes subcapsulares. Tenga en cuenta la falta de cuerpos amarillos o albicantia corpus, debido a la anovulación. Manifestaciones clínicas y diagnóstico:Las mujeres con SOP presentan con frecuencia la infertilidad o trastornos menstruales. Además, las mujeres con SOP parecen estar en mayor riesgo de complicaciones del embarazo, incluyendo la diabetes gestacional y trastornos hipertensivos, el riesgo de estas complicaciones se ve agravada por los embarazos múltiples (3). Anovulación crónica, la obesidad, hiperinsulinemia, y una disminución de los niveles de SHBG se asocian con el cáncer de endometrio. Resistencia a la insulina y sus condiciones asociadas, como la acantosis nigricans, la distribución de la grasa centrípeta, la obesidad y la obesidad, trastornos del sueño relacionados, son comunes con el SOP. A su vez, todos estos factores de riesgo de secuelas a largo plazo metabólicos, como la diabetes tipo II y enfermedad cardiovascular. El examen físico debe incluir una evaluación de la alopecia, acné, clitoromegalia, y la distribución de vello corporal, así como un examen pélvico para buscar la ampliación de ovario. Evaluación de diagnóstico propuestos para el SOP son: presión arterial; Índice de Masa Corporal (IMC) (peso en kg dividido por la altura en m2) (kg/m2), IMC = peso de 25-30,> 30 = obesidad, proporción cintura-cadera determinar la distribución de la grasa corporal, el valor> 0,72 = anormal, la presencia de los estigmas de hiperandrogenismo y resistencia a la insulina, tales como, acné, hirsutismo, alopecia androgénica, acantosis nigricans. Las pruebas de laboratorio es documentar hiperandrogenismo (testosterona total y / o testosterona libre o biodisponible) y la exclusión de otras causas de hiperandrogenismo - Los niveles de hormona estimulante del tiroides (la función tiroidea), los niveles de prolactina (hiperprolactinemia); 17-Hydroxyprogestrone (no clásica, la hiperplasia suprarrenal congénita causada por deficiencia de 21-hidroxilasa): nivel normal de azar <4 ng / ml o por la mañana en ayunas nivel <2 ng / ml. Dado que el síndrome de Cushing es extremadamente rara (1 en 1.000.000) y las pruebas de detección no son 100% sensibles o específicos, de detección de rutina para el síndrome de Cushing en todas las mujeres con anovulación crónica hiperandrogenismo no está indicada. Los que han co-existentes signos del síndrome de Cushing, incluyendo una cara de luna, joroba de búfalo, estrías abdominales, distribución de la grasa centrípeta, o hipertensión, deben ser examinados (4). Evaluación de alteraciones metabólicas: 2-horas de prueba oral de tolerancia de glucosa (glucemia en ayunas <110 mg / dl = normal, 110-125 mg / dl = deterioro;> 126 mg / dl = diabetes de tipo II), seguida por la ingestión de 75 g de glucosa oral y y luego 2 horas el nivel de glucosa (<140 mg / dl = tolerancia a la glucosa normal, 140-199 mg / dl = tolerancia a la glucosa,> 200 mg / dl = diabetes de tipo II). El ayuno de los lípidos y el nivel de lipoproteínas (colesterol total, lipoproteínas de alta densidad, triglicéridos) también deben ser considerados. Otras pruebas opcionales a considerar son: gonadotropinas determinaciones para determinar la causa de la amenorrea, el ayuno los niveles de insulina en las mujeres más jóvenes, aquellos con signos graves de resistencia a la insulina e hiperandrogenismo, o los someten a inducción de la ovulación. 24-horas de análisis de orina libre de cortisol urinario con inicio tardío de los síntomas de síndrome de ovario poliquístico o estigmas del síndrome de Cushing son útiles. Secretores de andrógenos tumores de ovario o de la glándula suprarrenal son siempre acompañados por niveles elevados de andrógenos circulantes. Sin embargo, no hay un nivel absoluto que es patognomónico de un tumor, así como no hay un nivel mínimo de andrógenos, que excluye de un tumor. Evaluación de los niveles de DHEAS puede ser útil en casos de virilización rápido (como marcador de origen suprarrenal), pero su utilidad en la evaluación común de hirsutismo es cuestionable. Leve elevación de los niveles de prolactina en las mujeres con SOP es común. Un prolactinomas que secretan grandes cantidades de prolactina y que pueden estimular la producción de andrógenos ováricos, pero esta es una causa muy rara de la anovulación crónica hiperandrogenismo (5). La evaluación de los niveles séricos de la hormona estimulante de la tiroides también es útil habida cuenta de las manifestaciones proteicas y la frecuencia de la enfermedad de la tiroides en las mujeres. El examen de ultrasonido de los ovarios para la evaluación inicial y la morfología antes de la inducción de la ovulación o en los casos de virilización o la conversión rápida a un estado de exceso de andrógenos es muy útil. 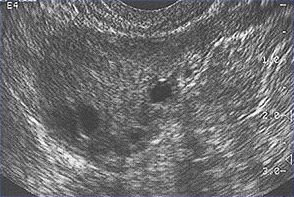 Esta imagen muestra los folículos del ovario en una mujer con ciclos ovulatorios regulares 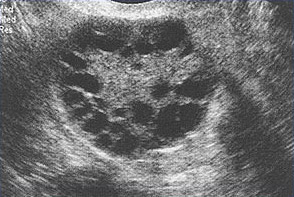 Múltiples folículos pequeños se muestran aquí en una mujer con SOP. Gestión:Las consecuencias clínicas de la anovulación persistente son: sangrado uterino disfuncional, amenorrea, infertilidad, hirsutismo, acné, aumento del riesgo de cáncer de endometrio y quizás el cáncer de mama; mayor riesgo de enfermedad cardiovascular y aumento del riesgo de la diabetes mellitus. La enfermedad de ovario poliquístico (SOP) con sangrado uterino disfuncional no intenten concebir:
Síndrome de ovario poliquístico (SOP) con la infertilidad:No hay pruebas de esquema de base para orientar las decisiones iniciales y posteriores de los métodos de inducción de la ovulación en mujeres con SOP. El tratamiento debe comenzar con un régimen de ejercicio regular y controlar el peso y luego proceder a otros métodos si es necesario. La mayoría suelen utilizar agentes para inducir la ovulación son los siguientes:
Perforación de ovario: el valor de la incisión ovárica laparoscópica con láser o diatermia como tratamiento primario para la sub-mujeres en edad fértil con la anovulación y el SOP es indeterminado. Ni de perforación por láser ni la diatermia tiene ventajas evidentes, y no hay pruebas suficientes para sugerir una diferencia en las tasas de ovulación o embarazo cuando la perforación se compara el tratamiento con gonadotrofinas como tratamiento secundario para las mujeres que no responden al clomifeno. Las tasas de embarazo múltiple se reduce en las mujeres que conciben después de la perforación laparoscópica. En algunos casos, los beneficios de la fertilidad de la incisión ovárica puede ser temporal, y la perforación no parece mejorar las anomalías metabólicas en mujeres con SOP (11). Paso a paso de acercamiento a Inducción de la ovulación en mujeres con SOP: Lo menos recursos, las intervenciones intensivas se recomiendan en los primeros pasos en el protocolo, mientras que la mayoría de los recursos, las intervenciones intensivas se reserva para su posterior tratamiento (12); Ovarios poliquísticos y fibromas uterinos:La falta de un efecto perjudicial de la SOP en el flujo sanguíneo de la arteria uterina en mujeres> 35 años coincide con el hyperandrogenization disminuido y la tendencia a ciclos más regulares reportaron mayores en mujeres con SOP. Podría ser la reflexión hemodinámica de la bioquímica como la mejora y la función ovárica en este grupo de edad. Además, el hecho de que el número de pacientes con SOP tenían fibromas uterinos en muchos estudios de las mujeres con ovarios normales no se ha informado anteriormente. Este hallazgo contradice un estudio que involucró a 21-69 años de edad, las mujeres African American utilizando cuestionarios de puestos para el reclutamiento de pacientes (13). La diferencia podría reflejar las dos gamas diferentes grupos de edad y las metodologías utilizadas en los dos estudios. La correlación negativa entre la presencia de SOP y los fibromas y la falta de asociación significativa entre la edad y los fibromas en mujeres con SOP en este estudio sugiere un papel protector para el PCOS en ese sentido. Era probable que la reducción de la perfusión sanguínea del miometrio en mujeres con SOP, como se muestra en este y otros estudios, fue un factor que contribuye en la reducción de sus probabilidades de desarrollar fibromas. Además, la tendencia hyperadrogenic con SOP, incluso en mujeres con ciclos menstruales regulares, podría haber tenido un efecto protector sobre los músculos del útero como fibromas suelen crecer más fácilmente en un entorno estrogénico. Este estudio (14) demostró que los pacientes con SOP tienen menos probabilidades de tener fibromas uterinos. El efecto perjudicial de la SOP en el flujo sanguíneo en el útero en mujeres con ciclos menstruales regulares agregó un aspecto hemodinámico a las anormalidades endocrinas se informó anteriormente en grupos similares de pacientes. Edad del paciente y la paridad modular los efectos de la SOP y los fibromas uterinos en el flujo sanguíneo de la arteria. En consecuencia, cualquier declaración sobre el flujo sanguíneo uterino a la presencia o ausencia de SOP o fibromas debe tomar estos dos factores en consideración. En las mujeres obesas con SOP, es la pérdida de peso mejora la función del ovario?La obesidad contribuye sustancialmente a anomalías reproductivas y metabólicas en mujeres con SOP. Múltiples estudios han demostrado que la pérdida de peso puede mejorar los aspectos fundamentales del síndrome endocrinos del SOP disminuyendo los niveles circulantes de andrógenos y causando la reanudación espontánea de la menstruación. Reducción del peso corporal se ha asociado con tasas de embarazo en la mejora y la disminución de hirsutismo, así como mejoras en los niveles de glucosa y de lípidos. Los estudios utilizando agentes farmacológicos pérdida de peso, como el orlistat y el inhibidor de la absorción intestinal de los lípidos, y la sibutramina, y el agente de anorexia, en mujeres con SOP han mostrado una mejora similar en la función ovárica (15). Mujeres con obesidad mórbida con SOP que se someten a cirugía de bypass experiencia de cerca de la normalización de las anomalías reproductivas y metabólicas. Estos cambios se han comunicado con la pérdida de peso tan sólo el 5% del peso inicial. La disminución de los niveles de testosterona no consolidados después de la pérdida de peso puede ser mediada en gran parte a través de aumentos de la SHBG (16). Los efectos de la pérdida de peso en mujeres de peso normal con SOP son desconocidos. Resumen:Síndrome de ovarios poliquísticos se define como la presencia de oligomenorrea o amenorrea e hiperandrogenismo en ausencia de otros trastornos del hiperandrogenismo, como tumores secretores de andrógenos o hiperplasia suprarrenal no clásica. La evidencia clínica de hiperandrogenismo incluye el hirsutismo y el acné. Las pruebas de laboratorio de hiperandrogenismo incluye un total elevado, la biodisponibilidad, o la concentración de testosterona libre. Séricos elevados de sulfato de dehidroepiandrosterona (DHEA) o los niveles de androstenediona también son evidencia de hiperandrogenismo. Las características morfológicas de "ovarios poliquísticos", como se demuestra en la ecografía pélvica no son esenciales para el diagnóstico de SOP, pero apoyan el diagnóstico. En las mujeres con SOP, muchas de las terapias disponibles para tratar la infertilidad anovulatoria, incluyendo la pérdida de peso, el clomifeno, el clomifeno más metformina, el clomifeno más glucocorticoides, las inyecciones de gonadotrofinas, la cirugía de ovario, la fecundación in vitro y transferencia embrionaria (FIV-TE). Todas las mujeres con SOP deben ser examinados para la intolerancia a la glucosa con un 2-nivel de glucosa una hora después de desafiar a un 75 de glucosa en ayunas. Las intervenciones que mejoran la sensibilidad a la insulina, incluida la pérdida de peso, el uso de la metformina, y el uso de las tiazolidinedionas, son útiles para mejorar la frecuencia de la ovulación en mujeres con SOP. El uso del citrato de clomifeno es adecuado, ya que efectivamente los resultados en el embarazo en mujeres con SOP. Las mejoras en la sensibilidad a la insulina, por la pérdida de peso o por el uso de agentes sensibilizadores a la insulina, favorable puede mejorar muchos factores de riesgo para la diabetes y la enfermedad cardiovascular en mujeres con POCS. Cuando se utiliza gonadotropinas para inducir, terapia con dosis bajas es recomendable ya que ofrece una alta tasa de desarrollo monofollicular y un riesgo significativamente menor de hiperestimulación ovárica en mujeres con SOP. El beneficio y el papel de la terapia quirúrgica en la inducción de la ovulación en mujeres con SOP es incierto. El mejor o el tratamiento inicial para el hirsutismo, inducción de la ovulación, o la prevención de secuelas a largo plazo del metabolismo de las mujeres con SOP es desconocida. Todas estas condiciones pueden beneficiarse de la modificación de estilo de vida. Referencias:
|