Sein d'évaluation des risques du cancerWHEC Bulletin de pratique et de directives cliniques de gestion pour les fournisseurs de soins de santé. Subvention accordée par l'éducation pour la santé des femmes et l'éducation Center (WHEC). la biologie du cancer du sein est un sujet de recherches intensives, et il ya eu des avancées énormes ces dernières années. aperçu scientifique en biologie des récepteurs d'strogènes a conduit à des avancées majeures dans la prévention des strogènes et de la chimiothérapie ciblée. densité mammaire accrue est apparue comme un facteur risque dominant, détectable, et modifiables pour le développement ultérieur de cancer du sein chez les femmes. Facteurs qui augmentent le risque d'une femme plus mûre de cancer, tels que la densité du sein, peuvent être identifiés dans la quarantaine. Amélioration des techniques d'imagerie, comme la mammographie numérique et l'IRM, peuvent être déployés efficacement dans petit groupe de femmes à haut risque d'arriver à un ratio plus équilibré et approprié de ne pas rapport coût-efficacité, mais aussi un préjudice aux prestations. Il est prudent de ne pas se fier à la mammographie de «résoudre» le problème de la détection précoce du cancer du sein. Sein d'évaluation du risque de cancer est un aspect de routine de soins de santé des femmes, et 3 modèles sont disponibles pour aider les cliniciens à cette tâche: Gail, Claus et Tyrer-Cuzick. Un quatrième outil - et de plus en plus commun est le dépistage génétique, qui peut être un élément important de l'évaluation du risque génétique pour certaines personnes. Les modèles disponibles pour les cliniciens pour évaluer le risque d'une personne du cancer du sein peut produire des estimations très variables, et les cliniciens doivent comprendre les limites de chaque modèle de choisir le modèle le plus approprié pour leurs patients. Le but de ce document est de discuter de l'application clinique des différents outils disponibles pour évaluer le risque d'une femme pour le cancer du sein et d'appliquer dans la pratique clinique. Cet examen donne également un examen approfondi de l'importance de la densité des seins comme un facteur de risque dominant pour le développement du cancer du sein, en soulignant le rôle que la génétique et les hormones jouent dans le maintien de la densité des seins chez les femmes ménopausées. Les recherches futures peuvent être orientées vers la détection de conditions préexistantes (comme les mutations de gènes) qui exposent les femmes à risque de cancers très agressifs. Recommandations pour les tests génétiques sont passées en revue, avec un accent particulier sur les composantes du conseil génétique, l'identification des personnes pour les essais, et l'interprétation des résultats des tests. Rappel des faits:risque à vie de cancer du sein pour la femme moyenne est d'environ 12% (1) . Les facteurs de risque du cancer du sein sont bien décrits. L'utilisation d'hormones exogènes (strogènes et progestérone) sont connus pour augmenter le risque et les facteurs hormonaux endogènes tels que l'âge des premières règles, la ménopause, et la première naissance sont associés à une légère, mais significative, augmentation du risque de cancer du sein. Les facteurs environnementaux, comme l'alimentation et la consommation d'alcool, mais pas bien compris, sont également associés à un risque de cancer du sein. Ayant subi une biopsie mammaire, et surtout une biopsie qui a démontré une hyperplasie atypique ou une néoplasie lobulaire, est associée à un risque significatif de cancer du sein (2) . A des antécédents familiaux de cancer suggère également une composante génétique à risque pour une personne. Beaucoup de ces facteurs ont été incorporées dans les modèles ci-dessous. Le sein est composé de trois principaux tissus - matières grasses, fibres / tissu conjonctif et des tissus épithéliaux. Les différences dans la quantité relative de ces tissus résultat de la variabilité entre les individus dans l'aspect radiologique des seins à la mammographie. La graisse est radioclaire et apparaît sombre sur la mammographie, alors que l'épithélium et du tissu conjonctif sont radio-dense et apparaît en clair sur la mammographie. densité mammaire mammographique (MBD) reflète l'apparence du sein à la mammographie et indique la proportion relative de radiographie dense, c'est à dire, blanc ou de domaines de la poitrine. Augmentation de la densité mammaire est associée à un risque plus élevé de cancer du sein indépendant de la difficulté accrue de la lecture d'une mammographie (3) . Les femmes blanches ont un risque plus élevé de développer un cancer du sein que les femmes noires (bien que les femmes noires diagnostic de cancer du sein sont plus susceptibles de mourir de la maladie). Autres facteurs de risque du cancer du sein ont été identifiés ou proposés, mais ne sont pas inclus dans le cancer du sein risque Outil d'évaluation pour plusieurs raisons: parce que la preuve que ces facteurs contribuent au risque de cancer du sein ne sont pas concluantes, parce que les chercheurs ne peuvent pas déterminer si ces facteurs ajouter des informations utiles aux facteurs déjà dans le modèle, ou parce que les données sur les autres facteurs de risque n'était pas disponible dans les données de recherche utilisés pour élaborer le modèle. Ces facteurs de risque suivants: âge à la ménopause, l'utilisation de la pilule contraceptive, haut indice de masse corporelle, une alimentation riche en graisses, d'alcool, l'exposition aux rayonnements, et les polluants de l'environnement. Récemment publié recherches indiquent que la densité du tissu mammaire, mesurée à partir de la mammographie, peut ajouter des informations utiles, mais des modèles de risque avec la densité du tissu mammaire de mesure doivent encore être validés par d'autres études indépendantes (3) . La recherche indique également que les autres facteurs de risque, tels que l'utilisation de l'hormonothérapie, pourrait améliorer l'outil. Introduction:Le cancer du sein d'évaluation des risques outil a été développé pour les femmes aux États-Unis population en âge de 35 ans ou plus (4) . Il ne doit pas être utilisé chez les femmes ayant déjà reçu un diagnostic de cancer du sein, les femmes exposées à des rayonnements du sein pour le traitement du lymphome de Hodgkin, ou les femmes qui résident dans, ou récemment migré, régions présentant un risque faible de cancer du sein, tels que la Chine rurale ou au Japon . Des méthodes plus précises pour des projets de risque peuvent être disponibles pour les femmes avec quelques rares mutations identifiées, telles que des altérations dans le cancer du sein gènes de susceptibilité BRCA1 et BRCA2. Le cancer du sein risque Outil d'évaluation a été élaboré et a été validé dans les populations provenant principalement de la non-hispaniques des femmes blanches. D'autres recherches sont nécessaires pour valider ou d'affiner le modèle pour d'autres groupes raciaux et ethniques. Le cancer du sein d'évaluation des risques Tool est un programme informatique qui a été développé par des scientifiques de l'Institut national du cancer et le National Surgical Adjuvant Breast Project et des intestins (NSABP) pour aider les fournisseurs de soins de santé dans la discussion risque de cancer du sein avec leurs patientes. L'outil permet à un professionnel de la santé du projet estiment individuelle d'une femme du risque de cancer du sein au cours d'une période de 5 ans et plus de temps de sa vie et compare le calcul du risque de la femme avec le risque moyen pour une femme du même âge. Le cancer du sein risque Outil d'évaluation peut être trouvé à: http://www.cancer.gov/bcrisktool . Comprendre les facteurs de risque:Bien que chacun de ces modèles offre un court et à long terme des risques, l'utilisation de risque à vie permet la comparaison des estimations du risque généré par chaque modèle. Une compréhension des limites de chaque modèle permettra aux cliniciens d'utiliser le modèle le plus approprié pour évaluer les risques et les conseils d'une femme dans une situation donnée. Pour plus d'informations pour aider vos patients à comprendre le risque du cancer visite http://understandingrisk.cancer.gov . Ce site Web interactif aidera vos patients prendre des décisions éclairées sur la façon de réduire leur risque. Le modèle de Gail:Ce modèle intègre (5) :
Risque relatif de développer le cancer du sein
Pour les femmes avec 0 ou 1 parent atteint, les risques augmentent avec l'âge à la première naissance vivante. Pour les femmes de plus de 2 parents au premier degré, la diminution des risques avec l'âge à la première naissance vivante. Ce modèle ne tient pas compte des antécédents familiaux chez les parents autre que la mère et la sur. Surtout, le modèle de Gail ne tient pas compte des antécédents familiaux de cancer du sein paternel. Ce modèle prédit le risque de cancer du sein dans 5 ans ou l'espérance de vie. Le nouveau modèle peut être utilisé pour des projets de risque de plus de 5, 10, 20 et 30 ans d'intervalle. Le nouveau modèle prédit des risques plus élevés que le précédent modèle chez les femmes ayant une densité mammaire élevée, et les analyses précédentes ont indiqué que le nouveau modèle était légèrement plus élevé de précision (6) . études de validation indépendante sont nécessaires avant que ce modèle doit être utilisé pour le conseil, et avant d'effectuer un changement permanent de la Breast Cancer Risk outil d'évaluation. Le modèle de Noël:Cette facteurs dans l'histoire de cancer du sein chez jusqu'à 2 première et / ou au deuxième degré ou paternelle parents maternels et l'âge auquel ces personnes ont été diagnostiquées avec le cancer du sein (7) . Cette information est utilisée pour calculer le risque fondée sur l'âge présent et risque à vie. risque à vie de cancer du sein selon les antécédents familiaux: Claus modèle (8)
Le modèle Tyrer-Cuzick:À l'heure actuelle, un outil de recherche, les tentatives de remédier aux limitations des modèles précédents en incluant une variété de facteurs de risque (9) . Le modèle utilise l'âge, l'indice de masse corporelle (IMC), les facteurs hormonaux et reproductifs, la maladie du sein, et une histoire de famille étendue pour calculer les risques personnels de cancer du sein. Une étude a montré que ce modèle produit un ratio plus élevé de s'attendre à observer des cas de cancer du sein que ne l'Gail et les modèles de Noël, ce qui indique qu'il peut produire une évaluation précise du risque de plus (10) . Ce modèle n'a pas encore été validées et doivent donc être utilisés avec prudence dans un contexte clinique. Cancer héréditaire du sein et du syndrome de cancer de l'ovaireEnviron 5% à 10% des cancers du sein héréditaires et 15% à 20% des cas de cancer du sein susceptibles d'avoir composante familiale et résultent de l'environnement, les interactions gènes (11) . Bien que BRCA1 et BRCA2 sont les gènes les plus souvent sélectionnés pour, ils ne sont probablement pas les seuls gènes impliqués dans le cancer du sein familiaux: en autant que 70% des cas, les essais de la personne dans une famille plus susceptibles d'avoir des rendements cancer héréditaire un résultat négatif . et BRCA2 mutations BRCA1 sont associées à un 45% à 85% la durée de vie risque de cancer du sein, avec l'âge moyen d'apparition de 43 ans pour BRCA1 et 45 ans pour BRCA2 (12) . Les deux gènes BRCA1 et BRCA2 sont associées à un risque de 50%> d'un cancer du sein primaire seconde. BRCA1 est associée à un risque à vie de 45% de cancer de l'ovaire, alors que BRCA2 a la moitié de ce risque (13) . Les chercheurs ont identifié les régions à BRCA2 qui sont associés à des taux plus élevés de cancer de l'ovaire; dans la pratique clinique, cependant, toutes les mutations délétères au sein de chaque gène sont donnés des taux similaires de risque de cancer. Familles avec ou BRCA2 mutations BRCA1 ont un risque accru de cancer de la prostate. Familles présentant des mutations BRCA2 sont à risque pour les cancers du sein masculin ainsi que du pancréas, du larynx, et la vésicule biliaire / cancers des voies biliaires, et le mélanome (13) . La prévalence des mutations BRCA1 et BRCA2 est estimée entre 1 sur 300 à 800 personnes de l'héritage européen et 1 à 40 personnes d'origine juive ashkénaze. Les tests génétiques pour les gènes BRCA1 et BRCA2, qui a été cliniquement disponibles pour les années, implique une évaluation de l'ensemble de la région de codage de chaque gène à la recherche de délétions importantes. Interprétation des tests génétiques peut être compliqué, surtout si l'importance de l'altération génétique identifiée est incertain. Dans ce cas, la mutation est étiqueté d'une variante "de signification incertaine» et ne peuvent pas être utilisés pour les essais des autres membres de la famille. En 2009, l'American College des obstétriciens et gynécologues (ACOG) a publié une recommandation que les femmes avec un 20% à 25% de chance d'avoir une mutation du gène BRCA1 ou BRCA2 objet d'une évaluation de risque génétiques et être considérés pour les tests génétiques (14) . ACOG définis femmes qui ont de 5% à 10% le risque de mutation du gène BRCA1 ou BRCA2 comme candidats potentiels à l'évaluation des risques génétiques. 2009 Recommandations ACOG pour les tests génétiques chez les femmes sont les suivants:
La valeur d'une analyse complète Pedigree:Étant donné que les gènes BRCA1 et BRCA2 sont associées à une variété de cancers, les patients doivent être posées sur tous les cancers connus et l'âge au moment du diagnostic chez les parents. Les patients doivent également être demandé spécifiquement sur les cancers présents dans la deuxième et de troisième degré (grands-parents, tantes, oncles, cousins et cousines en premier), cette information peut être utile pour identifier un mode autosomique dominant. Il est important de saisir l'histoire familiale des parents et de poser des questions sur l'adoption. Certaines situations peuvent cacher une histoire familiale de cancer héréditaire du sein et de cancer de l'ovaire. Les parents qui ont subi une hystérectomie ou une ovariectomie ont considérablement réduit leurs chances d'avoir jamais cancer du sein ou des ovaires. taille de la famille et de la distribution entre les sexes sera également influer sur la prévalence du cancer héréditaire dans une famille, par exemple, une petite famille très peu de femmes auront peu de membres-là mêmes qui pourraient exprimer les phénotypes (15) . Enfin, il est souvent utile d'examiner les dossiers médicaux des membres de la famille de développer des antécédents familiaux de cancer héréditaire, car tous les cancers gynécologiques sont égaux à cet égard. Interprétation des résultats génétiques:Un principe clé dans le dépistage génétique du cancer héréditaire est de tester la personne de la famille qui est le plus susceptible d'avoir ce cancer. Dans certaines familles, cette personne est un parent qui a reçu un diagnostic de cancer du sein. Essais cette personne ne peut déterminer si une mutation existe dans la famille, l'établissement d'un contexte dans lequel l'interprétation des résultats de tests génétiques des parents. Si une famille est connue pour avoir une mutation génétique, puis l'interprétation de l'essai d'un autre parent est simple: Un résultat positif pour la même mutation est associée à un risque accru de cancer. Un résultat négatif signifie que le patient est à risque de cancer moyenne; histoire de sa famille est liée à la présence d'une mutation qu'elle n'a pas hérité. Gestion des patients après des résultats peu concluants: Les scénarios suivants illustrent la difficulté d'interprétation négative BRCA1 / 2 résultats dans une famille ayant des antécédents de cancer, mais pas de mutation connue. Scénario 1: Un patient est diagnostiqué avec le cancer du sein à l'âge de 41 ans. Sa soeur a été diagnostiqué avec le cancer des ovaires à l'âge de 52 ans. Un patient est la personne dans cette famille les plus susceptibles d'avoir une mutation génétique, mais les analyses montrent qu'elle est BRCA1 et BRCA2 négatives. Interprétation: Ce test n'exclut pas un cancer héréditaire dans cette famille. Il n'est pas possible d'exclure le risque de cancer de l'ovaire chez un patient, compte tenu de son histoire familiale. Ainsi, le test génétique ne sont pas concluantes. L'évaluation des risques et plan de gestion pour le patient devrait être fondée sur son histoire familiale. 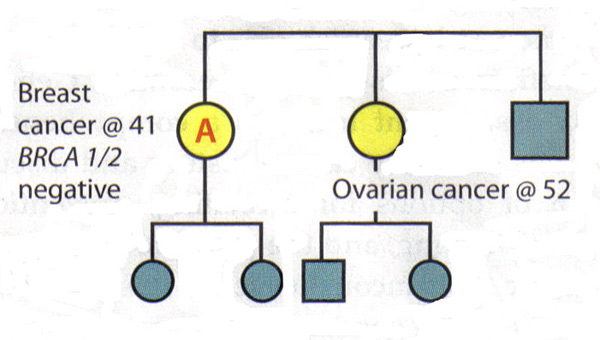 Scénario 2: défunte mère du patient B et la tante maternelle ont été diagnostiqués avec le cancer du sein et des ovaires, respectivement. Patient B demande dépistage génétique du cancer héréditaire - la première dans la famille de le faire - et découvre qu'elle est BRCA1 et BRCA2 négatives. Interprétation: En soi, ce résultat n'est pas concluant. Si sa mère avait une mutation, il serait alors possible d'en conclure que les résultats négatifs que le patient B est à risque moyen. Toutefois, depuis que sa mère et le statut tante est inconnue et il n'est plus possible de les tester, l'interprétation de ce résultat n'est pas clair. Il ne peut pas être une mutation dans la famille ou il peut y avoir une mutation que le patient B n'a pas hérité. Sinon, le test peut ne pas avoir été fait correctement ou il pourrait y avoir une mutation dans un gène autre que BRCA1 ou BRCA2. Par conséquent, le patient B devrait être gérée en fonction de son histoire familiale. 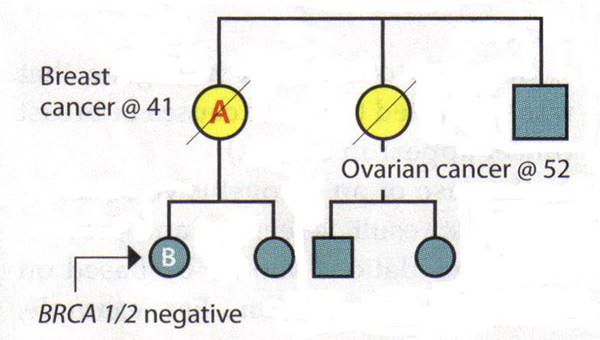 Causes du cancer du sein héréditaire:Les résultats négatifs chez un individu peut signifier plusieurs choses:
La densité mammaire mammographique (MBD) et risque de cancer du seindensité mammaire mammographique (MBD) reflète l'apparence du sein à la mammographie et indique la proportion relative de radiographie dense, c'est à dire, blanc ou de domaines de la poitrine. Plusieurs systèmes de classification ont été utilisées pour classer les MBD au fil des décennies. La première catégorisation a été parenchymateuses modèle de Wolfe qui a qualifié l'étendue et le type de la densité en 4 catégories (16) :
Actuellement, la mesure la plus fréquente en pratique clinique de la densité est le Breast Imaging Reporting et systèmes de données (BI-RADS) méthode de la densité, proposé par l'American College of Radiology (3) (17) . la densité de BI-RADS est une mesure subjective utilisée par les radiologues à classer une mammographie comme suit:
assistée méthodes informatiques sont utilisés pour estimer les mesures quantitatives de MBD, y compris la densité pour cent (pourcentage de la poitrine d'ensemble montrant tissu dense; PD), dense superficie absolue, et non-dense zone (3) (16) . MBD et risque de cancer du sein:Elevated MBD est considéré comme l'un des facteurs de risque la plus forte pour le cancer du sein quel que soit il est évalué comme une mesure quantitative ou catégorielle (16) . Les femmes dans les catégories les plus élevées de la densité du sein ont un 4 - à 6 fois le risque de cancer du sein a augmenté par rapport aux femmes dans les catégories les plus basses. MBD a été montré comme un facteur de risque plus forte pour le cancer du sein que les autres, sauf l'âge et des mutations génétiques (16) . L'association entre le cancer du sein et MBD a été vue à la fois chez les femmes âgées et les jeunes subissant une mammographie de dépistage, ainsi que dans du Caucase et de non-Caucasiens population. Influence hormonale de MBD:Il ya des preuves solides et cohérentes que MBD est influencée par des facteurs hormonaux tels que la ménopause, l'âge des premières règles, la parité, l'âge à la première naissance, et l'utilisation d'hormones exogènes (18) . L'influence des hormones exogènes sur MBD est illustré par des associations positives avec l'hormone de MBD ménopausées (PMH) et les associations de traitement inverse avec le tamoxifène (18) . Ces associations sont importantes parce qu'elles indiquent la variabilité inter-individuelle en réponse à l'hormonothérapie manifeste par les changements MBD, qui peut se traduire par le risque de cancer du sein différentielle. Avec l'épuisement des strogènes pendant la ménopause, le tissu glandulaire du sein de régression subit. Cela se traduit également par une diminution de MBD pendant et après la ménopause. Lorsque le processus est interrompu par PMH, les études évaluant MBD par des mesures quantitatives indiquent que ces hormones sont associées à une augmentation absolue de 3% à 6% en MBD (19) . Dans le norvégien du cancer du sein du programme de dépistage (19) , les utilisateurs actuels de la thérapie PMH était plus élevée signifie pour cent de manière significative MBD que jamais pour les utilisateurs n'ayant jamais utilisé (p pour la tendance <.001). De même, l'oestrogène ménopausées / Interventions progestatif (Pepi) de première instance, qui a examiné l'association entre le PMH et MBD, également connu une augmentation à l'hormonothérapie combinée (20) . Dans la Women's Health Initiative (WHI) étude, les femmes ont été randomisées pour recevoir tous les jours combinée estrogènes conjugués équins (CEE, 0,625 mg) et d'acétate de médroxyprogestérone (MPA, 2,5 mg) ou un placebo. Plus de 75% de femmes au PMH active a eu une augmentation de MBD (18) . Pris ensemble, ces études suggèrent que les strogènes et progestatifs-thérapies combinées à des doses conventionnelles sont associées à la densité du sein a augmenté, quel que soit le modèle de l'administration de progestatifs. Et, surtout, les associations de ces thérapies parallèles changement MBD les associations avec le risque de cancer du sein, telles que des augmentations du cancer du sein avec un traitement d'association, mais pas avec de l'oestrogène seul (21) . Bien que les posologies inférieures sont espérait avoir moins d'influence sur la densité du sein, une étude récente montre pas de différence entre les associations de classique et de la dose de traitement hormonal-bas avec la DMO (22) . Arrêt de 1 à 2 mois a été associée avec seulement de légères diminutions de MBD, et l'arrêt du traitement pour cette courte période n'a pas d'incidence sur les taux de rappel mammographie (22) . 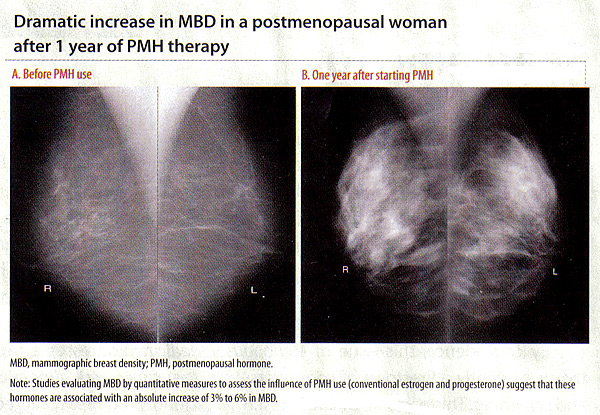 Influence du tamoxifène, le raloxifène, et inhibiteurs de l'aromatase sur MBD:Compte tenu de la corrélation positive entre PMH et MBD, la question logique est de savoir si le tamoxifène, le raloxifène ou inhibiteurs de l'aromatase de réduire MBD. Le tamoxifène: est un modulateur sélectif des récepteurs aux oestrogènes (SERM) qui se lie de manière compétitive aux récepteurs des strogènes et de la synthèse d'strogènes blocs. L'influence anti-strogénique sur la poitrine abouti à son utilisation comme traitement endocrinien adjuvant pour les femmes atteintes du cancer du sein oestrogène récepteur positif après la ménopause. Le tamoxifène a également été utilisé comme agent chimio-prévention pour réduire le risque de cancer du sein chez les femmes à risque élevé. Dans le sein National Surgical Adjuvant Bowel Project et (NSABP) essai clinique randomisé de femmes à haut risque, 5 ans de traitement par le tamoxifène a permis de réduire le risque de cancer du sein invasif de 49% et non-invasive du risque de cancer du sein de 50% par rapport au placebo (23) . Plusieurs études ont examiné les effets du tamoxifène sur MBD en utilisant différentes méthodes d'estimation de MBD et les populations étudiées (par exemple, les femmes avec cancer du sein connu ou à prendre le tamoxifène adjuvant des femmes à haut risque de cancer du sein sur le tamoxifène pour la chimioprévention). Ces études ont démontré que les femmes à prendre le tamoxifène ne connaîtra une réduction statistiquement significative de MBD. Certaines de ces études a noté que les diminutions pour cent MBD s'est produite à une plus grande fréquence dans préménopausées que chez les femmes ménopausées (24) . Commune à l'ensemble de ces études a été le fait que toutes les femmes à prendre le tamoxifène a connu une diminution de la densité du sein avec le traitement, la proportion des femmes qui connaissent une réduction de la densité variait de 21% à 80%. Cela a été considéré dans les études avec différentes méthodes d'estimation MBD, les populations (si les femmes à haut risque ou les cas de cancer), et, comme indiqué ci-dessus, différentes statut ménopausique. Cela suggère l'hypothèse que les diminutions des MBD induite par le tamoxifène dans une partie des femmes ont une importance clinique, ce qui entraîne moins de cas de cancer chez les femmes à risque élevé et moins de cas de récidive du cancer du sein controlatéral ou des événements parmi les cas. Ces femmes ont tout à gagner en restant à prendre le tamoxifène. En revanche, ceux qui voient dans la réduction de peu ou même augmente dans MBD peut être ceux qui voudraient bénéficier de méthodes de traitement alternatives. Le raloxifène: anthères agent SERM a été utilisé pour la chimioprévention du cancer du sein en raison de la réduction de la preuve du risque de cancers du sein invasifs après 5 ans de traitement (23) . Certaines études ont montré des diminutions similaires dans MBD chez les femmes sous placebo vs le raloxifène, alors que d'autres ont montré de petits changements dans l'utilisation du raloxifène MBD (25) . Dans une étude du raloxifène et MBD évalué que la densité du sein volumétrique de plein champ des images numériques, il est montré une légère réduction de MBD volumétrique dans le groupe raloxifène (médiane -4,1%; IC à 95%, -6,9% -2,1%), comparativement à une augmentation de la dose MBD vu PMH groupe faible (médiane de 15,0%, IC 95%, 4,8% -28,6%, p <.0001). inhibiteur de l'aromatase (IA): bloquer la synthèse locale d'strogènes dans les extraits de tumeurs du sein et de l'homme sont actuellement les plus efficaces du système endocrinien traitement aux oestrogènes positifs du cancer du sein post-ménopausique récepteur. Peu d'études ont examiné l'AI, le létrozole et MBD, avec des résultats mitigés. Il s'agit notamment d'une étude de 106 femmes ménopausées qui ont été randomisés pour soit du létrozole ou un placebo après 5 ans de tamoxifène, cette étude n'a trouvé aucune différence entre les 2 groupes dans la variation de MBD après 9 à 15 mois (26) . Les résultats contradictoires des études du raloxifène et AIS avec MBD peut être liée au fait que ces thérapies ne sont utilisés que chez les femmes ménopausées avec MBD de base moins élevé; de petits changements difficiles à détecter. Toutefois, les études à grande densité de mesures bien calibré et le suivi du cancer du sein sont nécessaires pour déterminer si MBD peut être utilisé comme un biomarqueur de ces et d'autres thérapies endocrines. Application clinique de MBD et risque de cancer du sein:Des études ont récemment intégré le BI-RADS et quantitative mesure MBD en prévision du cancer du sein des modèles de risque, qui a montré une certaine amélioration dans la prédiction du risque (amélioration de c-La statistique de 0,01 à 0,06) (27) . Un modèle amélioré avec une mesure MBD est donc préférable au modèle actuellement en vigueur Gail mais reste pauvre pour l'individualisation des risques. En outre, il est important de reconnaître les défis associés à l'évaluation clinique mammographies de femmes ayant augmenté de MBD, y compris la nécessité de mammographies répétées et des biopsies du sein et de la difficulté de détecter anomalies cliniquement significatives. Étant donné les liens entre les hormones exogènes et un changement de MBD, une question naturelle est de savoir si un changement de MBD est un marqueur potentiel de risque. En d'autres termes, si les femmes d'expérience avec l'utilisation accrue MBD PMH, ils sont plus à risque de cancer du sein que les femmes qui MBD réduire ou de maintenir tout le PMH? Ou si une femme à prendre le tamoxifène adjuvant diminue MBD, cela signifie qu'elle aura une réduction du risque de récidive par rapport à une femme qui n'a pas de changement dans MBD tout à prendre le tamoxifène? La plupart des études suggèrent que le changement de MBD pourrait être un biomarqueur pour la réduction du risque de cancer du sein chez les femmes subissant des stratégies de chimioprévention et pourrait permettre une identification plus précoce des femmes qui ne bénéficient pas de traitement par le tamoxifène (28) . Des études sont également en cours pour examiner l'influence des changements dans l'utilisation MBD PMH sur le risque de cancer du sein, et les résultats sont attendus prochainement. À ce moment, il n'est pas clair si les augmentations et les diminutions résultant MBD aux thérapies endocrines il suffit de changer la capacité de détecter de nouveaux cancers du sein ou se rapportent à la physiopathologie du cancer du sein. Des travaux supplémentaires sont nécessaires pour améliorer notre compréhension des agents qui contribuent aux changements dans le MBD et leur association avec le cancer du sein. En outre, le développement de reproductibles et bien calibré mesures de densité qui peut mesurer avec précision MBD sont nécessaires pour permettre la comparaison des changements entre les études et MBD types thérapie (28) . Résumé:l'évaluation des risques du cancer est un examen complet et la discussion sur le risque d'une personne pour le cancer. Cela comprend l'obtention d'informations concernant les facteurs qui peuvent atténuer le risque de cancer (par exemple, l'utilisation de l'hormonothérapie, l'utilisation de contraceptifs oraux, l'âge à la ménarche et la première naissance). D'autres éléments clés de l'évaluation du risque comprennent la discussion de la base génétique du cancer, antécédents familiaux de cancer, antécédents familiaux de cancer, risque de syndrome génétique, et des options pour le dépistage et la prévention. Les tests génétiques est un outil qui permet d'affiner l'évaluation des risques. Avant tout test génétique est effectué, les résultats possibles et leurs conséquences pour l'individu et sa famille devraient être discutées. Ce test a coûteuse valeur minimale à un patient qui n'est pas disposé à partager les résultats avec ses proches. Si les tests génétiques est approprié, le conseiller en génétique ou autre professionnel de santé peut faciliter les tests génétiques en enquêtant sur la couverture d'assurance, fournir les résultats des tests et des soins de suivi, et en aidant le patient d'informer les parents à risque. Comprendre la variabilité dans la réponse aux traitements endocriniens est important pour que la thérapie la plus efficace peut être administré à des patients en temps opportun. Cela inclut l'administration d'strogènes exogènes aux femmes en bonne santé pour réduire les symptômes de la ménopause ainsi que le traitement du cancer du sein pour les femmes atteintes de la maladie. MBD peut contribuer à notre compréhension de la variabilité inter-individuelle dans la réponse au traitement. Cette information peut ensuite traduire à la clinique pour faciliter la prise de décisions personnalisées concernant les options pour le traitement du cancer du sein et les stratégies de réduction des risques. Références:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||