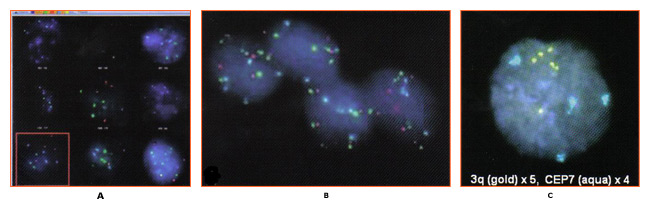
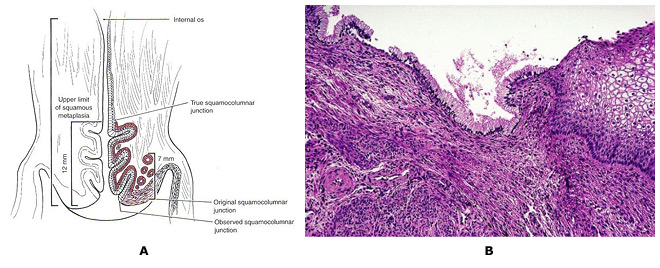
预防子宫颈癌:管理低等级的子宫颈瘤WHEC实践公报和临床管理指南为医疗保健提供者。 教育捐赠的妇女提供健康和教育中心(WHEC)。 子宫颈癌是女性最常见的癌症,以及由病毒(HPV)人类乳头状瘤病毒引起的。大多数性活跃的妇女在其一生中会获得人乳头状瘤病毒。虽然在大多数情况下清除感染,但它坚持在一些妇女。长期持续的HPV - 尤其是高风险类型 - 已被确立为一癌前病变必要的事业。子宫颈普查方案已经非常美国,欧洲和其他地区的成功,都能够实现广泛和持续的覆盖面。预防子宫颈癌现在可以更好。实践的重大修改的即将到来,由人乳头状瘤病毒与子宫颈癌发生的自然历史更好地了解动机。关于持久性宫颈癌的致癌性HPV感染在宫颈癌的发生基因型核心作用的基础上,人乳头状瘤病毒DNA检测已提交子宫颈癌普查。 1999年,美国食品和药物管理局(FDA)批准用于30岁以上妇女(杂交捕获2 cotesting第一致癌或高风险HPV的宫颈细胞学分类模棱两可,2003年DNA测试,Qiagen公司公司,马里兰州盖瑟斯堡)。美国癌症协会于2002年(ACS)和合作的研讨会由美国国立卫生研究院(NIH)赞助,美国国家癌症研究所(NCI),在阴道镜及子宫颈病理学会(ASCCP),美国社会并在2004年出版的ACS准则辅助人乳头状瘤病毒与子宫颈癌的细胞学检查,30岁,在美国老年妇女宫颈癌筛查(cotesting)测试。最近的证据表明,恶性肿瘤及癌前病变和子宫颈癌的HPV感染的风险显着不同的年龄。子宫颈癌预防的要领并没有多大改变,在过去的50年。拥有先进的技术,但没有改变基本的战略和性能。子宫颈癌筛查方案已经非常成功,因为子宫颈癌通常发展缓慢数十年。重复几轮筛选癌前病变赶上随着他们的成长,而他们可以很容易地处理。 这个文件的目的是讨论的HPV检测和细胞学检查异常与宫颈癌癌前病变和癌症的病理诊断的关系。这次讨论的重点是对损害的意义(子囊)和低度鳞状(LSIL组)上皮内病变的非典型鳞状细胞的管理。这对预防子宫颈癌系列,也将作为一个基准了解HPV疫苗接种,对未来的子宫颈癌筛查结果的影响。子宫颈癌的预防未来可能会更有效,因为它将包括:预防接种对致癌HPV感染青少年;为HPV检测发挥更大作用,在阴道镜改善提高灵敏度,并在屏幕的数量需要减少寿命预防。 所使用的缩写:原位腺癌 - AIS的 背景在2007年,超过13000名妇女诊断为美国子宫颈癌。巴氏使用(巴氏)涂片已记入与帮助预防子宫颈癌的死亡率降低70%以上的癌症发病率越来越宫颈癌(1)。然而,在美国,低度鳞状上皮内病变(LSIL组),初始步骤,宫颈细胞病变,诊断是每年约一万妇女。高风险的HPV菌株感染被认为是在开始的宫颈癌的发生最重要的因素。因此,HPV筛检已变得很普遍,是一个危险分层和临床管理准则的重要组成部分。到对宫颈异常管理的关键是建立有效的指导方针,以区别于很少癌前潜力良性子宫颈异常真实宫颈癌前兆。双方LSIL和CIN1反映细胞学与HPV感染和病理的影响。这些病变大多数人不会进步的癌症。然而,多达三分之二十八%的妇女细胞学LSIL组海港病变CIN 2或3,其中约二是确定了阴道镜(2)。从临床角度看,重要的是要区分哪些上皮内瘤病变会进展到浸润性肿瘤,如果不及时治疗。不过,目前可用的诊断类别只有适度的预测值,该值下降的病灶变得不那么严重。该进展为癌症的可能性较高,对进展时间是增加的不良等级短。 人乳头状瘤病毒与子宫颈细胞学检查一个HPV的高患病率,特别是在年轻女性中,不会导致颈椎病在大多数情况下。稳步下降,高风险是常见的HPV患病率随着年龄增长,整个计划是一致的子宫颈检查组与其他研究的国家的美国和其他发达国家(1)。这是可能的免疫系统清除HPV病毒随着时间的推移,而在一些个人子宫颈瘤的发展可能涉及到免疫系统故障或其他特定基因或环境因素对这些个人。癌症发病率的调查结果,即颈椎种族不同而有差异,可作为作者观察(1) ,用于在不同感染的自然历史或种族之间的差异,诊断和治疗。无论如何,HPV病毒似乎参与了宫颈病变的发展,并希望,现在的防疫程序为年轻妇女在地方会减少这种风险。 据美国癌症协会(ACS),估计有9,710新病例宫颈癌和3700 2006年美国因癌症死亡的子宫颈在国(2)。子宫颈癌的主要原因是HPV,性传播感染流行率的年龄和性伙伴数量不同而定。患病率是最高的性行为活跃谁正在为第一次接触的年轻女性,50岁以后逐渐减少了。在24岁以上的妇女一般都能够清晰无后遗症的人乳头状瘤病毒,但这个问题就不那么随着年龄的检测可能。子宫颈抹片是子宫颈癌及癌前病变非常有效的筛选试验,已用于自20世纪中叶之前的链接被发现的HPV。直到最近,它是唯一宫颈病变筛查测试可用。 2003年2月,美国食品和药物管理局批准和HPV DNA检测,可能与宫颈细胞学检测在子宫颈癌及癌前病变风险的妇女。超过100人乳头状瘤病毒亚型,目前已经确定,以上这些亚型40可以在子宫颈或阴道发现。 HPV的DNA检测技术,检测在宫颈癌找到多个亚型。根据现有证据的基础上,国家癌症研究所,美国阴道镜和宫颈病理学协会,加勒比国家联盟决定,30岁及以上的妇女可以同时使用筛选宫颈癌的人乳头状瘤病毒DNA的筛选和测试同时进行。妇女,对他们来说,测试发现是负面的,有一个3子宫颈上皮内肿瘤的风险大约是2或1 1000 (3)。因此,建议将其重新筛选至少每3年未更加频繁。细胞学阴性而积极的高风险HPV的妇女应在6-12个月重复这两项测试。细胞学异常或持续的高风险HPV者应进行阴道镜检查。对于30岁以下岁的妇女中,HPV的患病率非常高,虽然子宫颈癌的风险非常低,从而筛选HPV在所有妇女在30岁,会导致不必要的额外测试,如阴道镜检查或重复子宫颈检查,以一些研究结果具有重要意义。目前的建议是执行子囊)鳞状细胞意义(宫颈癌筛查的破坏与HPV反射测试的HPV与子宫颈抹片只显示非典型(4)。 在一个组织良好的子宫颈癌普查计划,HPV检测更敏感,比传统的细胞学检测CIN的癌症病灶及3 (5)。在这个大,从芬兰随机试验中,HPV检测有效运作作为主屏幕和子宫颈癌是子宫颈上皮内瘤检测比常规细胞学敏感三级变(CIN 3)或更高。这项研究的最大优点是刚刚超过58,000妇女和能力将研究成果1时01分随机参与者,在5年期间,芬兰人口使用综合数据库和癌症登记。一种担心,医师可能是研究结果是否适用于美国的人口,现已很少采用传统的细胞学筛查(液基细胞学检查是正常的)。这种担忧应该扫除一个大元分析,没有发现子宫颈抹片检测的灵敏度差异液基细胞学检查与常规(6)。尽管大尺寸,研究了有限的统计力量显示两个筛检方式对宫颈癌的发病率,主要是因为这个速度是如此之低,人口筛选的影响。为了确定这种影响,筛选选项需要重复又一轮的后续行动延长至10年。 HPV检测的临床应用Cotesting是标准的:美国从ACS的指南(2002年)和ACOG(2003,2009)提供临床医师的测试选项,筛选30岁以上的妇女同时使用细胞学和HPV - cotesting的做法被称为。然而,尽管大约90年%的女性有负谁应对这两项测试可以安全地放弃至少3供进一步筛选,许多临床医师屏幕上更频繁地cotesting,降低成本效益的选项本(7)。我们建议:您按照美国目前的指导方针和屏幕妇女30年,同时与抹片和HPV测试老年人和妇女谁延长对两个测试结果的负面筛选的时间间隔为3年。许多研究支持绝大多数的主要结论是,人乳头状瘤病毒在宫颈癌筛查试验显着提高CIN的3或更高的检测,并应减少妇女的宫颈癌的后续风险。 有两种人乳头状瘤病毒是否为基础的分流决定主要标准是临床上非常有用。首先,不分流测试(HPV检测)确定的妇女谁需要或不需要昂贵的转介程序,阴道镜及活检证明分流测试成本相当大的比例?也就是说,如果HPV检测几乎总是负的或正数,在使用它有什么价值。作为一个例子,后者,LSIL组细胞学与HPV)的低价竞标测试手臂把妇女称为子囊- LSIL组分流研究(在完成前被终止,因为大多数测试的HPV阳性(8)。第二个标准是,无论是人乳头状瘤病毒阴性的妇女可以安全地遵守,而不是发送到阴道镜。通过这些标准,分流人乳头状瘤病毒的妇女45岁或50岁以上老年人和LSIL组可能是合理的,因为这些HPV阳性率较低(低于80%)在CIN3和癌症之间非常低风险的HPV -阴性的妇女。这是观察欧洲的大型临床试验(9)。在低价竞标的意见和之间的差异是,低价竞标招收年轻女性为主(平均年龄24岁) (8)。 HPV检测可能是有用的任何年龄的阴道镜转诊分流为LSIL细胞学中老年妇女,但不适合在细胞学升序- H的(11)。 AGC的细胞学与妇女HPV检测结果可能不分流有用的,但可以指导临床医生的解剖部位,子宫颈或子宫内膜,可能存在一个问题:谁具有AGC细胞学检测HPV阳性的妇女有特殊的宫颈癌癌前病变和癌症风险高而那些谁检验HPV阴性有子宫内膜癌的高风险(10)。 HPV检测将变得越来越重要,区分高,低风险之间的HPV疫苗的妇女子宫颈癌前病变和癌症的模棱两可和轻度异常与细胞学妇女。在HPV16/18-vaccinated人口,这一研究(11)细胞学观察结果少的解释异常的HSIL的细胞学和减少疾病与人乳头瘤病毒16型优先,因为任何原因HSIL的细胞学和HPV 16和18两个最致癌的HPV基因型。部分保护由HPV疫苗对未来最致癌的HPV基因型,尤其是HPV31和HPV45,可能进一步减少HSIL的细胞学发生。因此,将有一对在HPV接种疫苗人群模棱两可的细胞学深刻转变。 宫颈发育不良分子标记在宫颈癌的分子发病机制研究的进展集中在分子标记在子宫颈癌筛查的发展。具体来说,第三季度的扩增染色体臂已被证实在宫颈癌组织中,也一直在观察肿瘤其他(12)。比较基因组杂交(CGH)技术使用的档案显示,DNA样本3号染色体(3q24区域到3q28)扩增与宫颈癌的发生有关。这是后来确定探针定位,为区域3q26序列的RNA组分的基因位于人类端粒酶(TERC),染色体可以作为一个第三季度扩增筛选试验,可能有助于评估病变发展个人(13) 。这是假设,因为高比例的不典型增生病变的TERC基因有额外的副本,TERC/3q可能有致病,但未经证实的不典型增生的作用,通过端粒酶的细胞永生化。此外,其他的基因定位于3q26区域,如PIK3CA,编码磷酸肌醇3激酶催化亚基,是与癌症相关的功能,包括细胞凋亡和细胞生长号关联的,都将要涉及的子宫颈癌的潜力致癌基因。 研究审议了第三季度收益与宫颈癌的发生关联的可能性转移到第三季度收益调查,可以预测宫颈疾病的进展。本研究(14)表明,尽管第三季度收益预测)的过程中100%的病例(CIN1 / 2发展到CIN3;缺乏第三季度的收益也能够回归量70%的预测。其他的研究表明,)生物标志物,如3季度(3q26在时间上与东道国人乳头状瘤病毒基因组关联融入(12)。因此,一个测试,确定第三季度的地位,应在triaging使用LSIL组患者。直到最近,第三季度获得常规测试是不可行的,因为评估所需的大量的染色,鳞状细胞细胞核(800)这是由传统的显微镜不切实际的分析。然而, 致癌鱼®宫颈细胞学标本试验是一种质的荧光原位杂交(鱼类)测试确定收购(在3q26区域)特定的染色体非整倍体。 致癌鱼上执行颈阴道细胞学标本,这些相同的HPV检测用于PAP和。通过测试评估两条鱼探针,为3q26位点和一个控制探头一使用3q26区域扩增。列举和比较3q26和控制探针与核形态,在一个原子核每个拷贝数第三季度的结果相结合,进行分析。尽管有几个因素促成了一个恶性发展到癌前病变,3q26增益是一个标记,医学专业可以使用,与其他试验的同时,帮助LSIL组病人的管理。 一个染色体3q26之间的地区和宫颈细胞病变的发展获得关系鉴定导致了该协会的确认,并暗示可能该观察临床应用研究报告。然而,应用在临床上第三季度收益以鱼类为主的液体细胞学标本的分析是具有挑战性。他们的鱼筛选信号的所有细胞中的标本目前是不现实的使用传统的显微镜分析。本方法的自动化特性有利于实现全面处理样品分析这是不可能的手动操作。 LSIL组样品分析识别多达20%的标本的标本,显示正常的水平,在第三季度收益高于观察(29)。一个在液体细胞学方法完全自动化的第三季度收益的测定法可能是必要实施常规检测(29)。进一步的研究来验证这一技术的实用工具是必要的。进一步的研究使用的细胞有超过五3q26鱼信号存在的基础这个测试,将能更好地评估其临床表现,并与现有的测试,结合其潜在效用,改善病人的管理。 第三季度收益的检测样本中的档案LSIL组 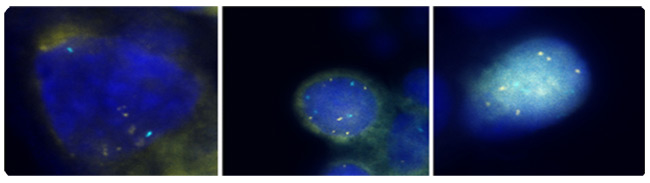 图2:第三季度荧光原位杂交(FISH)技术信号是有色金粒7鱼和控制信号的彩色旱厕 。全部3细胞表现出超过4年第三季度( 金)的鱼信号。照片提供:Ikonisys公司 颈椎病的临床应用试验致癌鱼致癌鱼颈椎医生提供额外的信息,可以帮助他们作出的决定更明智的临床管理。 LSIL组临床哪会进展到一个更高的档次?这将回归正常?恒指公司约10%至LSIL组确诊的患者会进展,60%将回归正常,将保持30%LSIL组(15)。 致癌鱼宫颈LSIL组帮助医生评估哪些病人可能倒退,并建议LSIL组疾病的风险较高的情况下进展。在众多的染色体变化观察子宫颈癌,最稳定的异常染色体臂在第三季度检测。研究表明,至少90%的病例的宫颈癌有一个手臂才能在第三季度(14)。进一步的研究表明前期工作进展情况,相关的颈椎病的严重程度之间的增益为3q26拷贝数(13)(14)利用这一技术发展看病人个体,它已被证明是CIN3灵敏度的3q26位点预测,从发展CIN1/CIN2至100%,特异性,即回归预测为70% (14) 。 致癌鱼宫颈发育不良信息提供了评估的临床前阴道镜。 宫颈转化区(TZ)致癌HPV感染是最容易造成口咽癌症转化区(TZs)凡符合两种上皮细胞,如子宫颈,肛门和(16)。该转换区(TZ)被定义为原始squamocolumnar之间的交界处和阴道镜新squamocolumnar交界处低洼地区。原来的鳞状和柱状上皮之间线性交界处取而代之的是鳞状上皮化生区按不同的成熟度。在这个区域的上限或头侧缘上皮细胞之间,这似乎形态鳞状借助了阴道镜放大光明,红色,绒毛上皮细胞,这似乎阴道镜柱状尖锐的划分。这阴道镜交界处被称为新squamocolumnar交界处。大多数妇女的临床初步评估年,是在后青春期。鳞状上皮化生成熟往往取代了柱状上皮远端或尾向限制。原来squamocolumnar交界处,是最常见临床表现为squamocolumnar分离上皮化生和鳞状原交界处。由于改造区的成熟,该路口变得不可能划定。只存在于成熟的鳞状上皮化生的柱状起源nabothian原始卵泡和腺开口提示。来源于宫颈肿瘤几乎总是在雅轩。鳞状上皮化生的理解是理解的颈椎TZ和宫颈癌的概念的关键。如果新squamocolumnar交界处被认为是在其全部的癌前疾病,发病率以上的鳞状缺席或头侧到新squamocolumnar交界处几乎是零。因此,如果新squamocolumnar交界处看到它的全部,阴道镜检查对宫颈的描述是令人满意的。如果新squamocolumnar交界处是没有看到它的整体,在阴道镜检查被描述为理想 。变革区域进一步界定了高档腺上皮内瘤样病变,病变的前兆宫颈浸润性腺癌远端限制。 虽然HPV感染,如阴道,阴茎和外阴,人乳头状瘤病毒引起的生殖器癌症发病率非常低得多的网站常见的是由于缺乏对TZs。鳞状上皮化生继续在整个一个女人的生活,最终,TZ是位于内的内部操作系统。因此,至关重要的是样本中筛选雅轩,但在OS中心将收集并不总是最优的细胞取样。可降低细胞萎缩,以及产量。有希望,人乳头状瘤病毒测试,包括子宫颈细胞可能减少假阴性与细胞学筛查。但是,无论筛选方法是使用一个诊断问题依然;即使正确执行,不能轻易诊断colposcopists在不良可见雅轩停经后妇女病变。 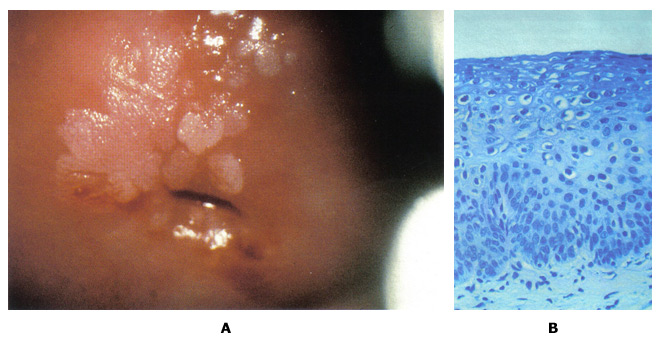 图5:一,阴道镜及宫颈的照片后,众多的醋酸展示acetowhite病变低度鳞状上皮内病变(LSIL)相一致的酸性。二病理结果显示损失在低极性的上皮细胞和大量挖空细胞,宫颈上皮内瘤一致,1级第三与HPV功能。 细胞学和组织学表现与诠释在贝塞斯达2001年的指引,ASC是subcategorized到不明显着(子囊)和非典型鳞状细胞,非典型鳞状细胞不能排除HSIL(升序- H)的。在这两个细胞学结果的管理准则差异与他们为CIN2,3所固有的风险。子囊是最常见的宫颈细胞学异常,所有的4.4%,占子宫颈抹片检查结果。尽管病人的癌症风险,任何个人是非常低(0.1 - .02%) (19),以及为CIN2风险,3 +还低(6.4-11.9%) (22),因为有那么多人与此细胞学异常,它是大约有一半的妇女为CIN2,3 +呈现细胞学结果。在妇女与子囊评价的第一步是谁在分流那些更密集的高风险评估(阴道镜)和指导测试更常规的后续行动。分流测试可能是由一个高风险(致癌)的HPV类型单一的重复测试或在6个月和12个月细胞学检查。当指数细胞学检查标本获得液基细胞学或HPV的标本时,共同收集,反射HPV检测是首选的方法(17)。数据显示,从低价竞标两个重复细胞学检查在6个月,在一子囊门槛十二个月为CIN2检测的88%,3 +在提到63.6%的妇女进行阴道镜检查。 HPV检测单独检测92.2%的为CIN2,3 +在提到55%的妇女进行阴道镜检查。 正常宫颈细胞学管理与HPV测试呈阳性:这些年来,老的最佳管理方法的HPV阳性,细胞学阴性的妇女30是重复测试在12个月细胞学和HPV (17)。 HPV的妇女,其结果仍是在重复测试12个月后,其正面或细胞学结果为ASC或更高应进行阴道镜检查,而妇女,其结果是在两个检测阴性可以推迟3年的筛选。 HPV筛检测试纳入到日常应保留为老年妇女和30岁(22)。在筛选细胞学研究从北美和欧洲,其灵敏度使用和HPV检测相结合的显着提高99-100%,比任一单独试验的预测值负(22)。妇女谁获得初始的细胞学和HPV检测阴性结果有一个小于1的有1000 CIN2或更大,在欧洲和美国未来的后续研究的风险表明,在10风险发展CIN3年的时间少于2% (23)(22)模拟研究表明,在30岁以上,筛选在3年时间利用细胞学和HPV检测相结合的妇女提供福利相当于或优于常规细胞学筛查每年提供更大。即使在妇女30岁以上,多数HPV阳性的妇女成为HPV阴性随访期间(60%的前瞻性研究) (22)。在一个良好的筛选人群中,妇女的风险范围为CIN2 +的HPV阳性,细胞学负2.4%至5.1% (23)。 管理(前年龄21岁)宫颈细胞学子囊和LSIL的青少年:浸润性宫颈癌的妇女是非常罕见的青春期之前,年龄21岁。美国国家癌症研究所的先见节目报道,从1995〜1999年宫颈癌的发病率是女性的侵入0年每10万个,每年为1.7 10-19岁妇女年,每10万年龄20-24岁(1)。由于HPV DNA的感染或阳性率最高的青少年人口,因为大多数人乳头状瘤病毒与细胞学检查有无异常将解决青少年感染没有接受治疗,目前的指南不建议在这个人口HPV检测在任何情况下使用,包括子囊分流和后续LSIL组注册的(17)(18) 。 2006年的ASCCP的子囊管理和LSIL青少年(20岁及以下)在协商一致的指导方针建议为2年12个月的间隔重复细胞学检查。如果ASCUS或LSIL持续一段时期的2年,临床医生应履行阴道镜(17)。这项建议是一个重大变化,从以前的指南,是根据多年的子囊和LSIL组自然史研究,演示了一项决议在2-3率高的疾病(18)。非常相似与子囊和LSIL年轻女性的临床结果,促使ASCCP建议为这些诊断都类似的管理办法。假设CIN2或更高已被排除CIN1由阴道镜,成人的前瞻性研究表明,人口与风险的CIN2年期间或更大的发展在整个2约为10% (19)。在青少年人群中,进展率要低得多,估计为3%,而CIN1率是非常高的分辨率(大于90%) (18)(19) 。因此,未经治疗CIN1最初的管理是强制性的。 特别注意事项:未成年人处于一个阴道镜检查可能会发现它有帮助的父母参与的程序。然而,阴道镜检查被认为是性传播疾病(性病)的评价,并允许未成年人同意,一般用于诊断和治疗性病的诊断。出于这个原因,虽然首选的父母同意,不应要求。如果没有得到父母同意,考试应获得同意从轻微并在病历显示。任何医疗提供者提供这样的关心谁应该充分了解自己的国家法律和公认的照顾地方标准。 宫颈细胞学的管理,而怀孕期间子囊LSIL组:在少女怀孕,这并不能改变细胞学检查异常和管理。宫颈管刮除术及切除程序不应该执行的,除非在怀孕期间被高度怀疑浸润癌(20)。筛选怀孕,因此,应在评价和宫颈细胞学异常的青少年进行管理。在怀孕,唯一可能改变管理诊断是侵入性癌症。癌症的治疗目标存在可能改变或变更路线和交货时间。因此,阴道镜检查在怀孕期间应作为其首要目标的浸润性肿瘤的排斥。对LSIL和HPV阳性子囊结果管理在怀孕期间应与非妊娠状态相同的,但这些条件的评价可能要等到分娩后推迟。 宫颈细胞学子囊管理与HPV阳性LSIL组患者(21岁及以上):虽然LSIL组细胞学的结果被认为是反映了人乳头状瘤病毒感染的细胞病变效应,而不是一个真正的癌前病变,与LSIL组妇女仍因为CIN2 +的中等风险。在低价竞标,27.6%的LSIL组的妇女被发现为CIN2 +无论是在阴道镜活检或密切随访年在未来2 (19)。这个比率是几乎相同的速度在女性的CIN2 +谁与HPV阳性子囊结果呈现在同一人群(26.7%)。 许多研究表明,两者的患病率LSIL组HPV DNA的积极性和为CIN2,有3名妇女随着年龄的跌幅(19)。精心筛选,与先前的负面结果绝经后妇女也同样在浸润性宫颈癌的风险较低。这表明,绝经后的妇女可能与LSIL组进行管理使用中的是与子囊育龄妇女使用相同的协议分流HPV检测。子囊存在的绝经后妇女较少常见,因为是重大的病理结果的风险。人乳头状瘤病毒DNA阳性率也急剧下降为妇女的年龄。这意味着每年HPV检测中老年妇女更有效,因为它是指一个流行率较低的CIN2,3是多间与ASC - H的比子囊女人,所以升序- H的,应视为代表模棱两可HSIL的妇女高。 后续评估后阴道镜子囊时,ASC - H的,没有为CIN2或LSIL,3注册:在低价竞标,最初只有58%阴道镜确定为CIN2 +的病变。对于没有发现有妇女为CIN2 +在最初阴道镜,为CIN2率在随访期间(约10-13%)+没有受到影响在阴道镜检查的结果(阴性结果并不活检,活检阴性活检或CIN1值得)。不同的盐类评估后阴道镜后续战略和执行的测试发现,人乳头状瘤病毒同样有效的12个月后的最初三个月时间间隔重复检查阴道镜和细胞学进行两个6 (19)。由于增加了额外的成本和缺乏敏感性,联合细胞学加HPV检测策略是气馁。在确定的情况下的CIN病理,诊断或烧灼手术切除是为了与LSIL组患者最初的管理不能接受的。后续无论是在12个月与HPV检测或在6个月和12月(子囊阈值)是可以接受宫颈细胞学检查。如果人乳头状瘤病毒DNA检测结果为阴性,或连续两次重复细胞学检查结果为阴性,返回到常规筛查建议。如果其中的HPV DNA检测结果为阳性或细胞学检查结果是重复报告为ASCUS或更大,阴道镜建议(24)。 宫颈细胞学管理升序- H的:流行的的CIN2,3是多间与ASC - H的比子囊女人,所以升序- H的,应视为代表模棱两可HSIL的妇女高。非典型鳞状细胞的妇女,不能排除HSIL(升序- H)的有有一个为CIN2,3例20-50%的风险,并应立即阴道镜检查评估。 - H的大多数妇女与ASC是人乳头状瘤病毒DNA阳性(从67-84%不等) (21),中间的分流是不恰当的和HPV测试是不推荐。如果为CIN2,3是不是阴道镜查明,21岁以上的妇女应进行监测的方式类似与子囊HPV阳性的妇女。 对CIN1管理前任HSIL及自动增益控制,没有其他特定(NOS)的:无论是诊断程序或切除观察6个月的间隔阴道镜和细胞学的一年是可以接受的女性和21岁或组织学的CIN1由恒指公司或AGC - NOS的细胞学结果在后一种情况是提供诊断老年之前在阴道镜检查是令人满意的,宫颈取样是否定的。切除过程的诊断建议由恒指公司或AGC - NOS的细胞学结果在其中的阴道镜检查是不能令人满意的,除非在怀孕,前面有CIN1妇女。未检测到为CIN2,3风险或原位腺癌(AIS)的病变,预计将在由HSIL或AGC的比由一个ASC或LSIL细胞学结果前面有CIN1妇女细胞学结果前面有CIN1妇女更大。子宫颈上皮内瘤2,3级是确定在84-97%的妇女与HSIL的细胞学)LLETZ评估结果转化区(带了一大圈切除术(26)。因此,独立的建议是由之前HSIL或AGC的细胞学病变。 整合HPV疫苗和筛选:在有限的卫生资源的世界,人乳头状瘤病毒疫苗接种和筛检的争夺注意力和资源。由于大规模的随机试验证明,两家持牌人乳头状瘤病毒疫苗是高度在16和18的有效预防新的感染与HPV (25)。可能有一些可能对人乳头状瘤病毒31和HPV45的交叉保护。少数的癌症是由于其它人类乳头瘤病毒类型并不包括在内。目前的疫苗不要把现有的感染或病变(25)。之前,他们必须给予曝光,在公共保健方案这意味着,接种疫苗是最佳的年轻少女。这不是没有集成支持的结合HPV疫苗接种和检查。预防性人乳头状瘤病毒的抗HPV 16和HPV疫苗的有效性是持续时间18日已接近了十年,疫苗接种覆盖率增加。因此,青少年的疫苗接种将在很大程度上防止在宫颈癌的发生(在性交开始后的年急性感染HPV)的第一步,特别是根据最终的评估涵盖更多新的HPV类型的疫苗。这些测试的所有宫颈癌筛查效果将减少由于减少癌症患病率预(27)。疫苗接种,特别是会降低效率,细胞学检查为基础的,因为越来越多的病灶仍然会滋扰相似者(特别是子囊)不致癌型HPV引起的,而不是在发展成癌症的风险(28)。因此,正在考虑各种建议,其中包括年轻妇女在接种疫苗的初步筛选和延迟一个重点从细胞学切换到主HPV检测。 建议摘要:下列建议是建立在良好的和一致的科学证据和专家意见对病人临床管理与异常宫颈细胞学(15)(17):
综述预防子宫颈癌现在可以更好。实践的重大修改的即将到来,由人乳头状瘤病毒与子宫颈癌发生的自然历史更好地了解动机。 2010年最颈椎方案仍依赖于筛选检测到异常使用阴道镜活检诊断宫颈细胞学之后。在细胞学和HPV检测相结合的敏感度非常相似,HPV检测孤独。这表明,人乳头状瘤病毒测试可能最终会作为一个单独的首要筛选细胞学或作为一个新的生物标记的检测后分流法以前是用于HPV阳性的妇女只。对第三季度收益和TERC扩增定期收集子宫颈抹片检测可以帮助确定发展具有高风险低度病变,并在降低假阴性细胞学筛查。关键的挑战是重新思考我们目前的防御模型的基础上频繁的细胞学和阴道镜转诊。不可避免的是,未来的方案将取决于疫苗,更频繁的检查,以及较少的处理,以允许解决HPV感染关。 致谢:妇女保健和教育中心(WHEC)博士罗伯特J Walat感谢,临床实验室主任,Ikonisys公司的纽黑文,电脑断层(美国)非常宝贵的建议,专家意见和援助,预防癌症的系列颈椎病。 资源
资金:预防子宫颈癌是一系列关于资助WHEC全球卫生倡议。这项计划是开展与妇女的健康和教育中心(WHEC)的合作伙伴,以消除/减少宫颈癌全球。联系我们如果您希望参与和/或加入的努力。 参考文献:
|