Perte récurrente de grossesseBulletin WHEC pratique et de directives cliniques de gestion pour les fournisseurs de soins de santé. Subvention à l'éducation fournie par la santé des femmes et de l'Education Center (WHEC). Perte de grossesse récurrente (RPL) est un problème frustrant pour les patients et les médecins. L'avortement spontané ou une fausse couche est définie comme la perte de grossesse avant 20 semaines de gestation ou le poids du ftus de 500 g ou moins. La grossesse est un processus compliqué impliquant de nombreuses interactions complexes entre le ftus et l'environnement maternel. La perte de grossesse peut résulter d'un certain nombre de facteurs génétiques, anatomiques, endocriniens, les troubles immunitaires, ou thrombotiques, ainsi que de causes inconnues (1). Malgré une évaluation complète, la cause de la perte récurrente de grossesse (RLP) ne peut être identifié plus de la moitié des couples touchés. Rassurer prudents et les encouragements sont importants - comme c'est un suivi attentif. Des pertes de grossesse récurrentes (RPL) n'impliquent pas l'inévitabilité. Même lorsque les patients ont RPL sans étiologie connue, les résultats futurs peuvent ne pas être lamentable. En considérant la probabilité de perte de grossesse, sans égard au diagnostic précis, une femme qui a eu aucune perte à la grossesse a une chance de 15% de perte avec la prochaine grossesse. Pour une femme avec une perte avant inexpliquée, le risque de perte à la prochaine grossesse s'élève à 13% et à 30% avec deux pertes inexpliquées. Même avec les patients qui ont eu quatre pertes de grossesses antérieures, toutefois, la chance de mener la prochaine grossesse à terme est de 60% (2). Les aspects les plus importants de la gestion du patient avec RPL sont fréquentes communications, l'éducation et un soutien émotionnel. Rassurer prudente devrait être offert comme la grande majorité, et environ 70% des patients en fin de compte parvenir à une grossesse réussie. Une surveillance attentive est justifiée parce que les femmes avec RPL sont également à risque accru de complications de la grossesse d'autres tels que la prématurité et les grossesses ectopiques. Le but de ce document est d'exposer les causes de la perte récurrente de grossesse (RPL) et de leurs thérapies potentielles, le cas échéant. La reproduction humaine est un processus inefficace. Seulement 15% à 30% du résultat ovocytes fécondés dans la grossesse viable. Après une évaluation complète et la réussite du traitement, les couples qui ont vécu un avortement spontané ont souvent peur de devenir enceinte à nouveau. Ces patients ont besoin de soutien intensif des médecins pendant leur premier trimestre. Cet examen peut servir comme une ressource utile lorsque le conseil des patients au sujet des options de traitement. DéfinitionPerte de grossesse récurrente (RPL) est actuellement définie comme trois ou plus de pertes de grossesse consécutive des grossesses cliniquement reconnues avant la 20e semaine de gestation (exclut - biochimiques, des grossesses ectopiques et molaires). Environ 2% des femmes ont deux défaites consécutives de grossesse. Traditionnellement, RLP, qui touche environ 1% des couples, se réfère à la perte de trois ou plusieurs grossesses consécutives. Cependant, le risque de perte troisième après deux fausses couches est d'environ 30%, alors que le risque après trois défaites est d'environ 33% (3). Parce que cette différence est très faible, de nombreux cliniciens commencera l'évaluation du RPL, après deux défaites. Cette approche peut être particulièrement utile chez les femmes âgées. RPL primaire se réfère à des patients qui n'ont jamais atteint la grossesse, alors que RPL secondaire se réfère à ceux qui les fausses couches suivi au moins une grossesse normale. Le risque de fausse couche est plus faible chez les femmes qui portent au moins une grossesse à terme, alors que des antécédents de fausses couches augmente les chances de fausse couche lors de grossesses ultérieures. L'âge maternel est également un puissant prédicteur de pertes récurrentes. ÉpidémiologieDes grossesses cliniquement reconnues, 10% à 15% entraîner un avortement spontané. La plupart de ces pertes de grossesse sont cliniquement manifeste par 12 semaines de gestation. Mort de l'embryon ou de pré-embryonnaire se produit habituellement au moins 1 semaine avant les caractéristiques cliniques de perte de grossesse en plus reconnu. Le risque de RLP était une fois pensé à augmenter progressivement avec chaque avortement spontané et aboutir à une femme ayant une probabilité de 80% d'un avortement spontané ultérieure après trois avortements spontanés. Actuellement, on estime que le risque spontané augmente avec le nombre de pertes de grossesse, mais très progressivement, et dépasse rarement 40% à 50%. Pour une femme qui a eu une naissance vivante, même si elle a eu plusieurs avortements spontanés, son risque d'avortement spontané dans les futures grossesses est de 30% par la grossesse (4). Facteurs de risque L'étiologie etLes causes de RLP sont largement acceptées. Le bilan de la RLP est négatif dans plus de 50% des patients (5). Cependant, la grossesse réussie se produit dans jusqu'à 35% à 80% des couples qui ont été évalués pour RPL, quel que soit l'étiologie et le traitement (5). En couple avec RPL inexpliquées ont des chances encore plus élevé de grossesse réussie. Étiologie de la perte récurrente de grossesse
Les facteurs de risque:
Diagnostic et prise enIl n'ya pas de nombre spécifique de pertes ou de critère clairement établi que l'évaluation des juges RPL ou définit le champ d'essai. Les décisions doivent être individualisées et la considération de l'âge de la femme, le calendrier et les circonstances entourant les pertes de grossesse plus tôt, les éléments de l'histoire personnelle et familial pour raison médicale, et au niveau du couple de l'anxiété doivent être prises en compte. D'investigation clinique et le traitement peut être envisagé chez les couples avec deux mandats consécutifs de pertes spontanée lorsque l'un des suivants sont présents: l'activité cardiaque embryonnaire observée dans toute la perte de grossesse plus tôt; caryotype normal sur les produits de la conception d'une perte plus tôt; âge> 35 ans, et l'infertilité . Anomalies chromosomiquesLes anomalies chromosomiques surviennent dans 64% à 88% des avortements spontanés isolés (5)(6). Parmi eux, 62% à 70% sont des trisomies autosomiques, 8% à 20% sont triploïdes ou tétraploïdes, et 6% sont liés aux anomalies chromosomiques structurelles. La prévalence des anomalies chromosomiques dans RPL est d'au moins 50% et est généralement liée à l'âge maternel. Chez les patients subissant une fécondation in vitro (FIV), l'échec préimplantatoire est associée à des anomalies chromosomiques dans 67% à 85% des cas (7). Caryotype de l'embryon préimplantatoire de patients atteints d'avortement récurrent démontre un taux six fois plus élevé de monosomies. Aneuploïdie récurrents (nombre anormal de chromosomes) peut être démontrée dans plus de deux tiers des grossesses ultérieures après le diagnostic d'une première grossesse. L'étiologie des anomalies chromosomiques n'est pas complètement compris. Anomalies qui surviennent pendant le compte division méiotique première pour la majorité de l'aneuploïdie. Le mécanisme exact par lequel cela se produit est sous enquête. Les facteurs génétiques qui sont dépendant de l'âge, tels que les sites fragiles sur les chromosomes, des inversions, et les translocations, compte pour 3,5% à 4,4% du RPL d'aneuploïdie. Parmi ces derniers, les translocations sont le plus souvent trouvés dans RPL. Il ya deux grands types de translocations: la réciprocité, dans laquelle deux segments de chromosomes différents sont échangés, et Robertsonienne, dans lequel il ya fusion au niveau du centromère de deux chromosomes acrocentriques. Translocations équilibrées peuvent entraîner des transporteurs normale, mais peut conduire à des réarrangements déséquilibrés dans la descendance et donc fausse couche. La perte de grossesse est plus fréquent avec des translocations maternelle. Fréquence et la distribution des anomalies chromosomiques dans cliniquement reconnue conceptions humaines (8):
Facteurs utérinsCongénitales et acquises utérine compte des anomalies pour 10% à 15% des femmes avec RPL et sont identifiées par sonohysterography (SHG) ou hystérosalpingographie (HSG) (9). Imagerie par résonance magnétique (IRM) peut être nécessaire de différencier avec précision l'utérus cloisonnées et bicorne. Anomalies des voies de Müller: Les anomalies congénitales du manifeste des voies de Müller comme un spectre de constatations, de cloisons partielles pour compléter la duplication des voies génitales supérieures (voir figure ci-dessous). L'utérus cloisonné est l'anomalie la plus courante de Müller, le plus étroitement corrélé avec la perte de grossesse (65% le taux d'avortement spontané), et la malformation la plus facilement et avec succès corrigé par septoplastie hystéroscopique. Didelphe utérin et l'utérus bicorne sont associés à environ 40% le taux d'avortement spontané. Toutefois, les procédures métroplastie abdominales sont rarement indiqués pour les femmes avec un utérus ou didelphe un utérus bicorne. Cerclage du col utérin peut contribuer à améliorer l'issue des grossesses chez les femmes dont l'utérus bicorne et dans ceux qui ont un utérus unicorne ou un didelphe l'utérus qui ont une histoire de livraison ou d'exposer previable progressive raccourcissement du col en début de grossesse. 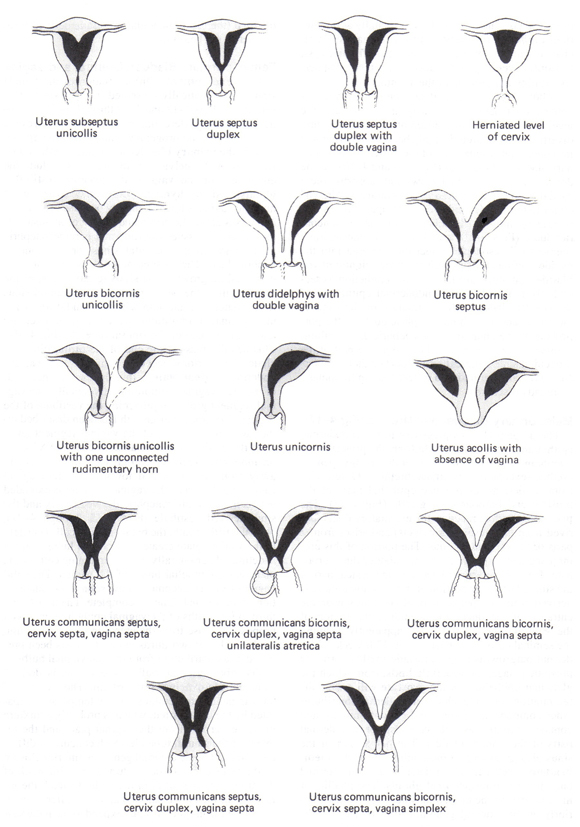 Figure 1. Anomalies congénitales utérines Fibromes utérins et autres facteurs anatomiques: Les fibromes utérins sont souvent identifiées chez les femmes avec RPL, mais seulement myomes sous-muqueux et les grandes myomes intra-muros qui empiètent sur ou à déformer la cavité utérine sont significatifs. Adhérences intra-utérines sont une cause rare mais qui sont établis sur RPL, avec issue de la grossesse après lyse hystéroscopique. Enfin, bien que diéthylstilbesterol (DES) a été interdit en 1971, les femmes touchées sont encore parfois vu. Environ 70% des femmes exposées au DES in utero ont un développement anormal utérines et ont un risque deux fois plus élevé d'avortement spontané, environ 24% (10). Cerclage doit être envisagé chez les femmes ayant des antécédents d'exposition au DES et la perte du deuxième trimestre ou un accouchement prématuré. Maladies infectieusesBien que l'infection est une cause fréquente de cette dernière grossesse, un mauvais pronostic de la grossesse, aucune association cohérente entre les infections et RPL a été démontrée. Ni la chlamydia, ni espèces de mycoplasmes, causes fréquentes de prématurité et d'autres complications après le premier trimestre, a été concluante identifiée comme une cause de RLP. Ceux-ci peuvent toutefois être associés à la perte de grossesse non récurrents ou sporadiques. Un dépistage sérologique systématique, des cultures cervicales, et biopsie de l'endomètre pour détecter les infections génitales chez les femmes avec RPL ne sont pas justifiées. Evaluation de l'infection doit être limité aux femmes ayant une cervicite, chronique ou récurrente vaginose bactérienne, ou d'autres symptômes d'infection pelvienne. Causes endocriniennesLes troubles endocriniens sont la cause relativement rare de la RA, mais comprennent: le diabète sucré, maladie thyroïdienne infraclinique; syndrome des ovaires polykystiques (SOPK); hyperprolactinémie et les défauts de la phase lutéale. Évaluation des niveaux de glycémie et d'hémoglobine A1C est indiqué pour les femmes présentant un diabète sucré connu ou suspecté, mais est autrement injustifié. Il est établi que le diabète sucré bien contrôlée n'augmente pas le risque d'avortement spontané. Troubles de la thyroïde sont faciles à identifier et à traiter et doit être exclue par hormone stimulant la thyroïde (TSH) de mesure, et même des anomalies subtiles peuvent affecter les résultats de la grossesse, bien qu'il existe une controverse s'il ya une vraie relation à RPL. Résistance à l'insuline est également associée avec RPL, et SOPK a été associée à un avortement spontané. Cela peut être médiée par une altération de la réponse fibrinolytique comme en témoigne le fait que les femmes souffrant du SOPK et RPL ont des niveaux élevés d'inhibiteur de l'activateur du plasminogène-1 (PAI-1) (11). Des niveaux élevés de PAI-1 peuvent entraver l'implantation et l'invasion du trophoblaste médiée par type urokinase plasminogen activator. D'autres facteurs potentiellement embryotoxiques trouve en excès dans le liquide folliculaire des patients SOPK comprennent le glucose, l'insuline-like growth factor-1 (IGF-1), et les taux d'androgènes. SOPK ne suffisent pas à prédire le risque de fausse couche. Toutefois, l'obésité est associée de façon indépendante avec une perte de grossesse. Rétrospective et petites études cas-témoins ont montré que la thérapie à la metformine réduit le risque de PRL chez les femmes souffrant du SOPK de 42% à 62% à 26% à 29% (11). Agrandir études prospectives sont nécessaires pour confirmer cette association. Niveaux élevés de prolactine ont été associés à la RA, et le traitement par la bromocriptine a été montré pour augmenter la probabilité d'une grossesse normale. Défauts phase lutéaleL'incidence des défauts de la phase lutéale - vérifiée sur biopsie de l'endomètre, en démontrant une absence d'effet de la progestérone dans le cycle prévu - est le même pour les femmes fertiles que pour ceux ayant des antécédents d'infertilité (12). Ainsi, malgré la théorie raisonnable que le défaut de la phase lutéale est une cause potentielle de RPL, juste comment il est diagnostiqué reste incertain. La prévalence de l'anomalie de la phase lutéale, dans lequel il ya une carence relative en progestérone, est de 2,5% chez les patients RPL (12). Bien que beaucoup de la littérature disponible a été contradictoire, une revue Cochrane de 15 essais contrôlés randomisés ont conclu que, à partir de progestatif supplémentaires dans le premier trimestre de la grossesse améliore les résultats pour les patients en rechute, mais pas isolée, la perte de grossesse dans le premier ou le deuxième trimestres (13 ). Étant donné les avantages des données indiquant, pour les femmes avec des pertes second trimestre-, date à laquelle le placenta a repris le rôle de la progestérone sécrétant, la théorie derrière l'efficacité de la progestérone dans ce cadre est son action comme un relaxant musculaire lisse. Voies d'administration et les doses de progestatif varie selon les études examinées. Certaines études suggèrent que la FIV progestatif oral est inférieure à une formulation par voie intramusculaire (14). Surtout avec une population d'infertilité, il est important avec une supplémentation en début de ne pas commencer trop tôt. Les données montrent que la FIV un endomètre trop accélérée pourrait effectivement réduire le taux d'implantation de l'embryon. Par conséquent, lorsque la supplémentation est fourni avant le résultat du test de grossesse positif, le patient doit être surveillance de l'ovulation. Pour les patients avec RPL, certainement si elle s'est produite dans le premier trimestre - supplémentation devrait continuer au moins jusqu'à l'âge gestationnel de 9 semaines. Implantation arrive environ une semaine après l'ovulation, mais il ya une marge de manuvre dans le calendrier. Parfois les patients oublient de prendre leurs suppléments progestatif que plus tard dans le cycle, et aucune différence dans les taux de grossesse a été noté. Traitement des défauts de phase lutéale- La progestérone suppositoires vaginaux: 25 mg deux fois par jour à partir du 3 jours après l'hormone lutéinisante (LH) contre les surtensions et se poursuivant jusqu'à huit semaines de gestation; La progestérone dans l'huile par voie intramusculaire (IM): 12,5 mg / jour IM début 3 jours après le pic de LH et continuant jusqu'à huit semaines de gestation; Progestérone micronisée: 200 mg / jour par voie orale commence 3 jours après le pic de LH et jusqu'à huit semaines de gestation; Le citrate de clomiphène: 50 mg / jour par voie orale pendant 5 jours à compter de jour 3-5 du cycle menstruel (pas de supplémentation de grossesse nécessaire). Des facteurs immunologiquesLes deux mécanismes auto-immunes et allo sont impliqués en tant que causes de la RA. Maladies auto-immunes impliquent une réponse immunitaire dirigée contre une partie spécifique de l'hôte ou l'auto. Troubles alloimmune impliquent une anomalie de réponse immunitaire aux antigènes maternels ftales ou placentaires dont maternelle anticorps cytotoxiques, en l'absence de la mère des anticorps bloquants, et troubles de la fonction des cellules tueuses naturelles et de la distribution. Maladies auto-immunesMaladies auto-immunes comme le lupus érythémateux systémique (LES) et le syndrome des antiphospholipides (SAPL) sont des troubles identifiables et traitables et sont associées à la RA. L'anticoagulant lupique et les anticorps anticardiolipine, anticorps les plus largement acceptées de l'utilisation clinique, et ont été associées à une variété de problèmes médicaux, y compris les thromboses artérielles et veineuses, thrombopénie auto-immune, et la perte du foetus (15). En plus de la perte ftale, plusieurs complications obstétricales ont été associés à des anticorps antiphospholipides, dont la prééclampsie, retard de croissance intra-utérin, insuffisance placentaire, et l'accouchement prématuré. Syndrome des antiphospholipides (SAPL)Le syndrome des antiphospholipides (SAPL) est une maladie auto-immune définie par la présence de signes cliniques caractéristiques et les niveaux spécifiques de circulation des anticorps antiphospholipides. Comme environ 70% des personnes atteintes de SAPL sont de sexe féminin (16), il est raisonnablement fréquent chez les femmes en âge de procréer. Les anticorps antiphospholipides sont un groupe diversifié d'anticorps ayant une spécificité pour la liaison aux protéines phospholipides chargés négativement sur la surface cellulaire. Malgré l'importance clinique de la prévalence et la SAPL, il ya controverse sur les indications de tests SAPL et les tests qui doivent être commandés pour diagnostiquer la maladie. Beaucoup des résultats débat d'un manque d'études bien conçues et contrôlées sur le diagnostic et la gestion de SAPL (17). syndrome des antiphospholipides primaire renvoie aux patients atteints de SAPL, mais pas d'autres maladies auto-immunes reconnue (18). Cependant, d'autres maladies auto-immunes comme le LED coexistent souvent avec la condition. Quand il se produit dans le cadre d'autres maladies auto-immunes, il est désigné comme le syndrome des antiphospholipides secondaire(18). SAPL défini est considéré comme présent si au moins l'un des critères cliniques et l'un des critères de laboratoire sont remplies (17): Clinique d'obstétrique:
Thromboses vasculaires:
Laboratoire
Gestion des SAPL pendant la grossesse: Les objectifs du traitement pour les SAPL pendant la grossesse sont d'améliorer la santé maternelle et ftale et néonatale en réduisant le risque de perte de grossesse, la prééclampsie, une insuffisance placentaire, et de naissances prématurées et de réduire ou d'éliminer les risques maternels thrombotiques. Deux études récentes (19) ont souligné que les séries de cas et des essais de traitement ont tendance à inclure les personnes dont le diagnostic SAPL tombe dans l'un des deux groupes: ceux ayant des antécédents d'événements thrombotiques et ceux sans histoire. Traitement des femmes atteintes de SAPL sans événement thrombotique est controversé. Une méta-analyse récente a suggéré que, pour les femmes avec une fausse couche récurrente que les critères cliniques, l'héparine prophylactique et aspirine à faible dose peut réduire la perte de grossesse de 50% (20). Cette thérapie combinée semble supérieure à la faible dose d'héparine seul ou la prednisone. Pour les femmes avec SAPL sans histoire d'un événement thrombotique, certains médecins recommandent l'initiation de l'héparine avant la conception, bien qu'aucun essai clinique appuie cette recommandation. La plupart des experts recommandent 6-8 semaines post-partum de la thromboprophylaxie chez les femmes avec SAPL obstétrique (21). Plusieurs approches de la gestion du péripartum du traitement anticoagulant chez ces patients sont disponibles. La direction de notre institution est la suivante:
Le traitement peut être initié après la préconception à la viabilité documenté avec aucune différence détectable dans les résultats (22). D'autres thérapies qui ont été suggérées pour le traitement des femmes enceintes avec SAPL comprennent les corticostéroïdes et les immunoglobulines intraveineuses (IGIV). Plusieurs séries de cas ont rapporté un taux de 60-70% de grossesses réussies chez les femmes avec SAPL traités par l'héparine et de la prednisone à faible dose (22). Parce que l'efficacité des IgIV n'a pas été prouvée dans des études bien conçues et que le médicament est extrêmement coûteux, il n'est pas recommandé comme traitement primaire. Troubles alloimmuneL'acceptation de l'allogreffe ftale et placentaire par les résultats du système immunitaire de la mère de l'expression du trophoblaste non immunogène HLA-G; Fas ligand; agents immunosuppresseurs tels que l'hCG, la PAPP-A, et la progestérone, et augmenté les niveaux de cortisol maternel. Partager HLA entre mari et femme a été théorisée au résultat en l'absence d'un anticorps spécifique à la grossesse qui protégeait le ftus demi-étrangers de rejet maternel. Cependant, toutes les méthodes actuelles d'évaluation des présumés alloimmunopathology, y compris les tests HLA, de l'évaluation des cellules immunitaires (lymphocytes mixtes de culture, naturel dosages cellules tueuses), et les tests de cytokine sont expérimentaux. Aucune des deux principaux immunothérapies préconisée pour le traitement des troubles alloimmune chez les femmes avec RPL, la vaccination des leucocytes paternels et immunoglobuline IV, ont fait leurs preuves pour être efficaces (23). Héritée thrombophiliesThrombophilies héritées résultant de mutations génétiques dans les facteurs de coagulation conduisant à la thrombose placentaire ont émergé comme une cause potentiellement importante de RPL (24). Cependant, la majorité des femmes porteuses de ces mutations ont tout à fait normal résultats de la reproduction. Les femmes avec plus d'un type de mutation ou dont le ftus hérite de la mutation peut être à un risque accru d'avortement spontané. Les indications pour le dépistage des femmes avec RPL pour le nombre croissant des thrombophilies reconnus ne sont pas encore établies. Actuellement, le dépistage semble approprié pour les femmes avec RPL ailleurs inexpliquée avec une perte suspectes (après la gestation de 10 semaines ou de détection de l'activité cardiaque embryonnaire) ou des antécédents de complications de la grossesse d'autres qui peuvent avoir résulté de l'insuffisance de thrombose ou placentaire (pré-éclampsie, une restriction de croissance intra-utérin, décollement placentaire). En plus de l'anticoagulant lupique et les anticorps anticardiolipine pour le diagnostic de thrombophilie acquise, le dépistage comprend des tests pour le facteur V Leiden et G20210A mutation du gène de la prothrombine. Ils sont les deux plus courantes des causes héréditaires de la maladie thromboembolique veineuse et les thrombophilies plus fortement associés à des résultats défavorables de la grossesse (25). La prévalence de ces mutations est relativement élevé parmi ceux d'ascendance européenne (jusqu'à 15%) mais très faible sur les Asiatiques, les Africains et les Amérindiens (25). Mesure de la protéine de résistance C activée est un test plus global pour la détection des deux formes héréditaires et acquises de la protéine C activée résistance. Dépistage de la méthylène tétrahydrofolate réductase (MTHFR) la mutation, l'homocystéine sérique et l'antithrombine III, protéine S, et les carences en protéine C peut également justifier un examen, basé sur les antécédents médicaux passés et de la famille (26). Compte tenu des données disponibles, il n'ya pas de preuves suffisantes pour soutenir le dépistage de la thrombophilie dans le cadre de l'évaluation initiale du RPL. En outre, on ignore si le traitement améliorera l'issue de grossesse chez ces femmes. La plupart des pertes de grossesses précoces sont dus à l'aneuploïdie et idéalement à toutes les femmes avec RPL (et de mort foetale) devrait avoir croisière d'endurance complet, y compris caryotype des pertes pour exclure d'autres causes avant d'attribuer les pertes de thrombophilies. Thrombophilies sont convaincante associée à un risque relatif accru de mort ftale, mais pas avec récurrents du premier trimestre une perte. De même, le traitement peut aider ceux qui sont atteints de thrombophilie et de mort foetale, mais le traitement n'a pas été testé chez les femmes avec récurrents du premier trimestre la perte et la thrombophilie. Des données préliminaires suggèrent que le traitement combiné avec de l'aspirine et l'héparine peuvent améliorer les résultats de grossesse chez les femmes avec RPL et thrombophilie, mais prospective, des études contrôlées sont nécessaires. Environnementaux et autres associationsLe tabagisme augmente le risque d'avortement spontané et devrait être découragée. La consommation d'alcool supérieure à deux verres par jour et une consommation élevée de caféine (plus de 300 mg / jour) peut augmenter le risque de perte de grossesse et de mieux les éviter. Les toxines environnementales telles que les métaux lourds (mercure, plomb), les solvants organiques (par exemple perchlorethlene ou nettoyage à sec solvant), les rayonnements ionisants, et les gaz anesthésiques ont été impliqués comme agents causals d'avortement spontané (27). L'exposition aux terminaux vidéo, couvertures électriques, ou de lits d'eau chauffés n'est pas associée à un risque accru de RLP. Les programmes d'exercices n'augmentent pas le risque, et le repos au lit ne sera pas diminuer le risque de RLP.
Abbreviations: SHG -- sonohysterography; HSG -- hysterosalpingography; MTHFR -- methylene tetrahydrofolate reductase; TSH -- thyroid stimulating hormone; SuiviAprès une évaluation complète et la réussite du traitement, les couples qui ont vécu un avortement spontané ont souvent peur de devenir enceinte à nouveau. Ces patients ont besoin de soutien intensif des médecins pendant leur premier trimestre. Il est utile d'informer les couples qui le risque d'avortement spontané diminue à mesure que la durée de la grossesse augmente: l'observation d'un sac gestationnel (12%), le sac vitellin (8%), augmente la longueur embryonnaire cranio-caudale (> 5mm, 7%; 6-10 mm, 3%;> 10 mm, <1%). L'observation de l'activité cardiaque embryonnaire en gestation 6 semaines réduit le risque d'avortement spontané à 3% - 5%. Toutefois, l'incidence des avortements spontanés ultérieurs est plus élevé quand il ya d'autres signes échographiques anormales: des divergences lente ou tard l'activité cardiaque apparaissent, la taille et / ou la date, ou un hématome subchorionic. Enfin, la valeur pronostique de l'activité cardiaque embryonnaire diminue avec l'augmentation de l'âge maternel taux d'avortement spontané de moins de 5% des femmes de moins de 35 ans à 29% chez les femmes âgées de 40 ans et plus. RésuméL'avortement spontané est la complication la plus fréquente de la grossesse. 40% à 50% des conceptus sont perdus avant les règles attendus, et 30% à 35% sont perdus au cours ou après les menstruations manquées. Perte de grossesse Traditionnellement récurrentes (RPL) se réfère à la perte de trois ou plusieurs grossesses consécutives, mais de nombreux cliniciens commencera l'évaluation du RPL, après deux défaites, car le risque d'une troisième défaite, après deux fausses couches est d'environ 30%, alors que le risque après trois défaites est d'environ 33%. Cette approche peut être particulièrement utile chez les femmes âgées. Le risque de fausse couche est plus faible chez les femmes qui portent au moins une grossesse à terme, alors que des antécédents de fausses couches augmente les chances de fausse couche lors de grossesses ultérieures. L'âge maternel est également un puissant prédicteur de la perte récurrente. Les principales causes de RLP sont chromosomiques, anatomiques / utérine, endocrinien, immunitaire, et thrombophiliques. L'évaluation de couple avec RPL devrait inclure les éléments suivants: caryotypes parentaux, l'évaluation de l'utérus avec sonohysterography (SHG), HSG, et / ou l'hystéroscopie; évaluation du SAPL: anticoagulant lupique, les anticorps anticardiolipine, anticorps anti-β2-glycoprotéine-I; un bilan des hérité de thrombophilies si les pertes ont eu lieu après 10 semaines et le niveau de prolactine sérique. Le bilan de la RLP est négatif dans plus de 50% des patients. Cependant, la grossesse réussie se produit dans jusqu'à 35% à 80% des couples qui ont été évalués pour RPL, quel que soit l'étiologie et le traitement. Il est important de se rappeler que les couples qui sont en cours d'évaluation pour les RLP ont des niveaux élevés de dépression et de stress. Certaines études ont indiqué que le soutien psychologique peut diminuer le taux de fausses couches inexpliquées. Enfin, les patients doivent être rassurés que même sans traitement, la grossesse réussie survient dans la majorité des cas. Références
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||